文章信息
文章题目:Technological advances in cancer immunity: from immunogenomics to single-cell analysis and artificial intelligence
日期:2021-08-20
期刊:Signal Transduction and Targeted Therapy
链接:https://www.nature.com/articles/s41392-021-00729-7

介绍
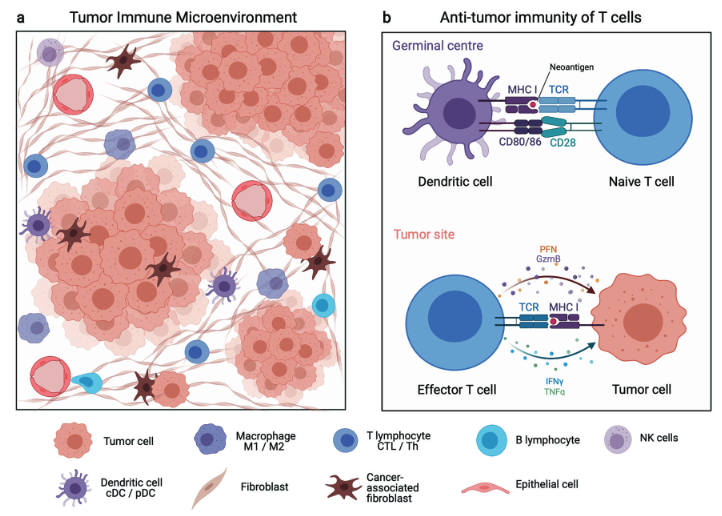
肿瘤细胞与附近的细胞一起存在于复杂的细胞群落中,这强烈影响肿瘤细胞的生长、行为和与其他细胞的交流。在这些细胞中,免疫细胞是关键的参与者,许多研究证明肿瘤细胞和免疫细胞之间的交流是双向的。事实上,免疫细胞既能促进也能抑制癌变、肿瘤进展、转移和复发。因此,文章主要关注肿瘤免疫微环境(TIME)。
最近的肿瘤免疫治疗策略,如免疫检查点阻断 (ICB)、癌症疫苗和过继细胞转移 (ACT) 治疗,已显示出前所未有的临床疗效。然而,面对治疗耐药性和不良反应等,它们的应用因对肿瘤免疫的不完全了解而受到阻碍。
TIME简介
过去的研究发现,肿瘤不是单纯的肿瘤细胞,而演变为由群落中的肿瘤细胞、免疫细胞、成纤维细胞、血管内皮细胞等基质细胞组成的复杂器官样结构,它涵盖器官内的所有结构,如免疫浸润、血管、细胞外基质等。肿瘤周围,也称为肿瘤微环境(TME),一直是目前最热门的研究课题之一。
TIME的成分主要有两大类,即免疫细胞和分泌因子,如细胞因子、趋化因子和生长因子。关于前者,TIME 包含极其多样化的免疫细胞亚群,包括 T 淋巴细胞、B 淋巴细胞、自然杀伤 (NK) 细胞、巨噬细胞、树突状细胞 (DC)、粒细胞和髓源性抑制细胞 (MDSC) 等。通常,T 细胞、B 细胞、NK 细胞和巨噬细胞有助于抑制肿瘤生长,而 MDSC 和调节性 T 细胞 (Tregs) 往往会抑制抗肿瘤免疫。
不过鉴于免疫细胞与肿瘤细胞的复杂相互作用,免疫细胞的特定作用可能会发生动态变化,甚至完全相反。例如,CD8+ T 细胞的抗肿瘤功能可能会通过 T 细胞的耗竭而受到抑制,而在糖酵解低的肿瘤中阻断 CTLA-4 后,Treg 细胞对产生干扰素-γ 的细胞的功能失稳可能会促进抗肿瘤免疫。
所以,无数种免疫细胞类型,甚至特定免疫细胞类型的不同功能状态都可能对抗肿瘤免疫产生相反的作用
NGS时代的免疫组学技术——免疫基因组学
过去的二十年里,包括全基因组测序 (WGS)、全外显子组测序 (WES) 和 RNA 测序 (RNA-seq) 在内的 NGS 已成功开发并应用于获取人类全基因组信息。与 Sanger 测序相比,NGS 产生高通量的基因组和转录组数据,为研究多步免疫反应奠定了基础。NGS 时代利用免疫基因组学的研究不仅通过生物信息学算法提供了 TIME 免疫细胞组成的更详细视图,而且还通过异常肽预测、人类白细胞抗原 (HLA) 分型和主要组织相容性复合物 (MHC) 来识别免疫原性蛋白-肽结合亲和力预测。
TIME中免疫细胞的量化
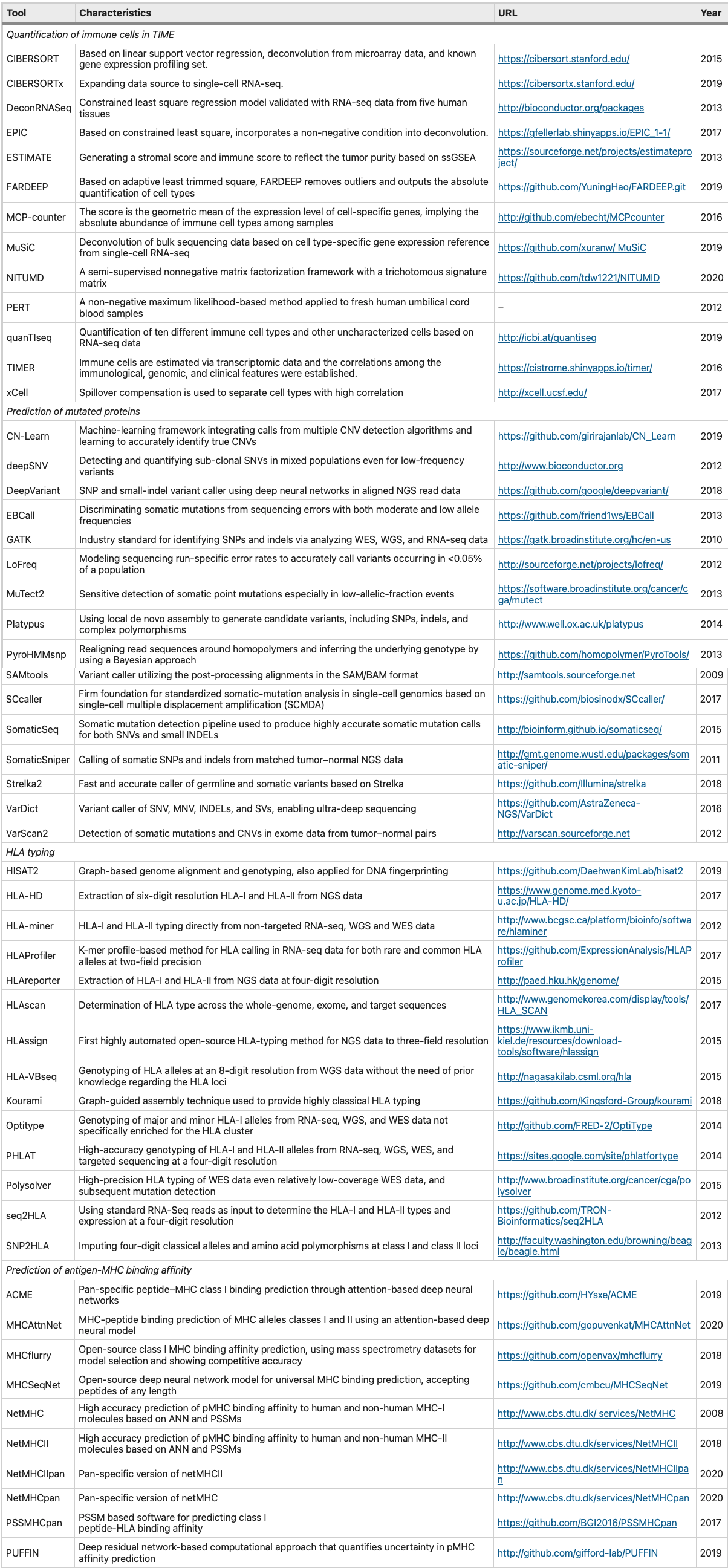
对于 TIME 中肿瘤免疫细胞成分的量化,使用传统方法如流式细胞术和免疫组织化学 (IHC),由于其高成本和低组织可用性,对于大规模分析是不切实际的。考虑到细胞高度的异质性,不同免疫细胞类型之间的基因表达谱差异很大,可以在一定程度用表达量上代表免疫细胞类型。因此,我们能够通过 NGS 数据估计数十种免疫细胞类型的丰度。近几年开发了一系列肿瘤免疫基因组学计算工具:
还有一系列算法:
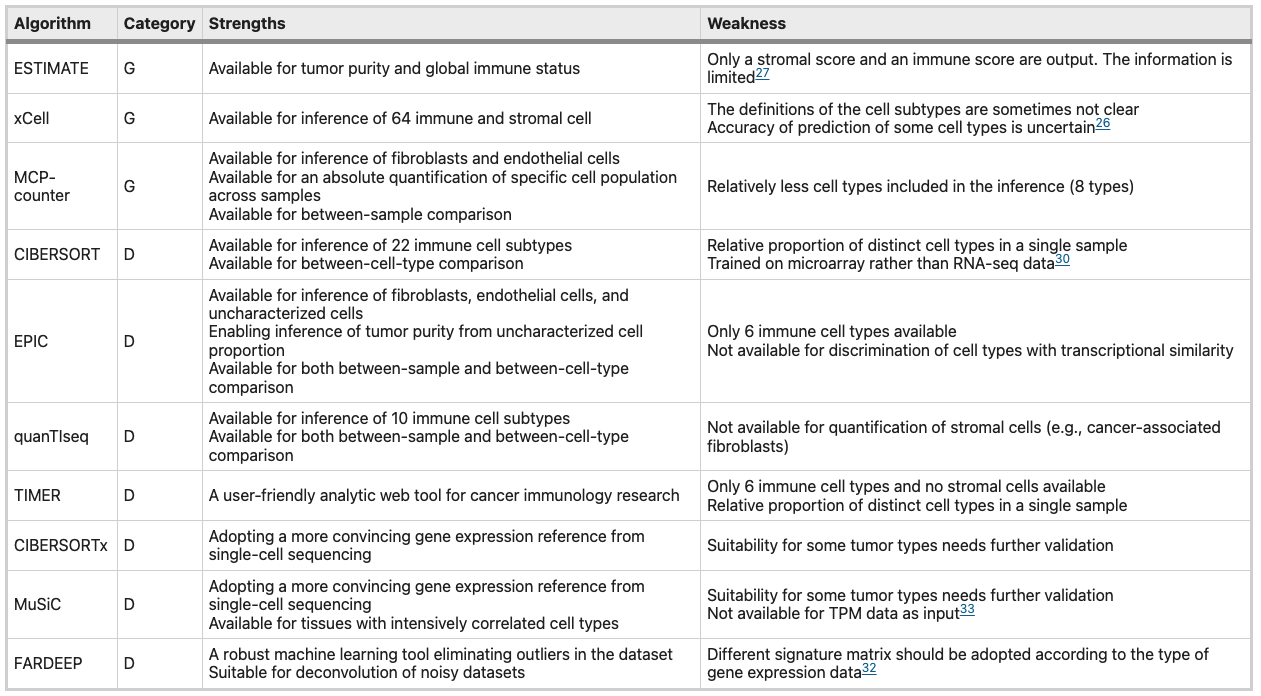
ESTIMATE 算法提供免疫评分和基质评分来表示免疫细胞和基质细胞的比例和分布,但不能区分特定的免疫细胞类型 xCell 是另一种基于 ssGSEA 的方法,与 ESTIMATE 相比,xCell 可以更好地区分具有高相似性的细胞类型 MCP-counter根据标记基因表达水平的平均值为每个样本中的每个 TIME 细胞群(不仅包括免疫细胞,还包括内皮细胞和成纤维细胞)生成一个分数,用来表示细胞丰度 基于反卷积的工具包括 DeconRNASeq、PERT、CIBERSORT、TIMER、EPIC、quantTIseq 和 deconf。CIBERSORT 是最流行的基于反卷积的算法之一,它利用线性支持向量回归和基因表达特征矩阵来表征免疫浸润成分
肿瘤抗原的鉴定
基因组水平的突变、转录组水平的突变和蛋白质组水平的改变都会引起异常蛋白即肿瘤抗原的表达,这些蛋白可以被免疫细胞识别并引发抗肿瘤免疫反应。这些抗原中,病毒抗原、癌种系抗原和新抗原(由体细胞 DNA 改变产生的肿瘤特异性抗原)具有较高的肿瘤特异性,因此已成为主要的肿瘤疫苗靶点。根据抗原识别的过程,免疫基因组学技术通过计算机分析预测异常肽段、进行HLA分型和预测MHC-肽段结合亲和力,对于肿瘤抗原的鉴定有很大帮助。
从 WES、WGS 或 RNA-seq 数据预测异常肽段
体细胞 DNA 突变,包括单核苷酸变异 (SNV) 、插入和缺失 (INDEL),是异常蛋白质的主要来源。
GATK是用于通过分析 WES、WGS 和 RNA-seq 数据来识别 SNV 和 INDEL 的行业标准,能够涵盖拷贝数变异 (CNV) 和结构变异 (SV)。相比之下,VarScan2 和 SomaticSniper 需要更高的等位基因分数以保证足够高的灵敏度。但是,关于假阳性或假阴性,这些工具中没有一个在能每方面胜出,因此建议在实践中选择两种以上的工具来预测异常蛋白质。
HLA分型
异常肽需要结合 HLA 以帮助 T 细胞受体 (TCR) 识别以引发免疫反应。HLA 基因是人类基因组中最多态的基因,包含 I 类(A、B 和 C)的三个主要基因位点和 II 类(DP、DQ 和 DR)的三个主要基因位点。不同的HLA对异常蛋白质具有不同的结合亲和力。因此,对于抗原识别至关重要,预测 HLA 分型对于识别肿瘤抗原至关重要。
随着技术发展,血清分型和细胞分型方法逐渐被DNA分型方法所取代。HLA-miner 和 Seq2HLA 是用于从 NGS 数据中进行 HLA 分型的两个早期工具,极大地减少了时间和成本。后来的PHLAT、HLAreporter、SNP2HLA、HLA-HD、Optitype 和 HLA-VBSeq表现都不错。其中,Polysolver 可实现高精度 HLA 分型,是目前使用低覆盖 WES 数据的公认标准工具之一。
预测抗原-MHC 结合亲和力
除了识别异常肽段和 HLA 分型外,抗原-MHC 结合亲和力是肿瘤抗原预测的下一个重点。
人类的MHC分子分为以下三个亚型:I类、II类和III类。I 类 MHC 分子 (MHC-Is) 由所有有核细胞表达,并将细胞内肽(如病毒和肿瘤抗原)呈递给 CD8 + T 细胞以引发免疫反应。此外,在 DC、巨噬细胞和 B 细胞等专业抗原加工细胞 (APC) 上表达的 II 类 MHC 分子 (MHC-II) 呈递外源肽以激活 CD4 + T 细胞;MHC III 不是细胞表面的标记物,此处不作讨论。
与 MHC-II 分子相比,MHC-I 分子结合 8 到 11 个氨基酸之间的较短肽段。目前广泛使用的工具有 NetMHC 和 NetMHCpan。MHC-II 的形成过程与 MHC-I 相似,但它通常结合长达 30 个氨基酸的较长肽。NetMHCIIpan 可能会成为首选。
单细胞时代的免疫组学
除了TIME中的免疫细胞和肿瘤细胞外,TIME中的所有细胞都具有高度异质性,并且具有独特的基因表达谱和膜蛋白表达。单细胞技术将彻底改变我们对肿瘤免疫的理解,并将研究水平从组织水平转变为单细胞水平。
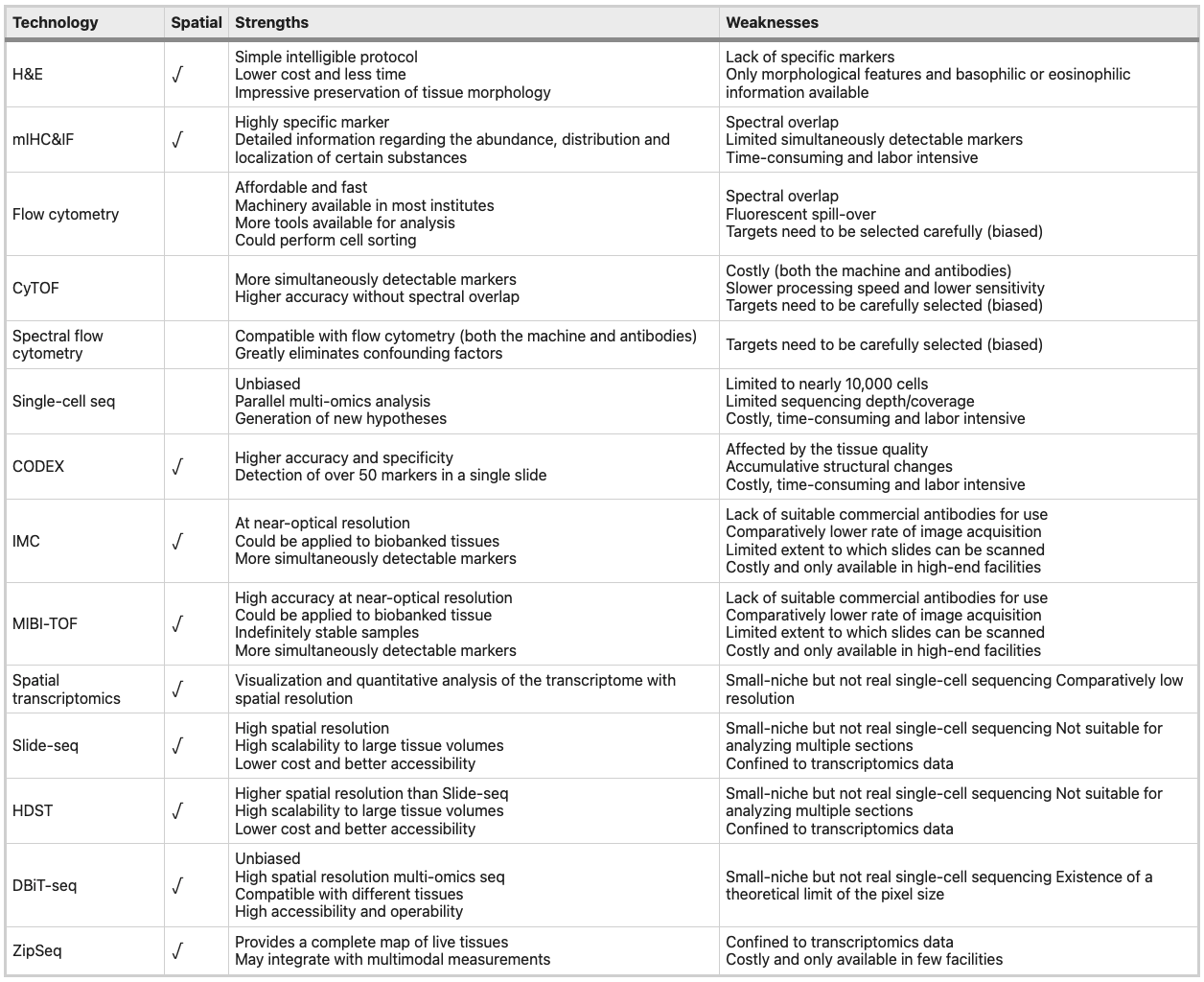
这里比较了一些单细胞水平免疫组学技术:
基于蛋白质的单细胞分析
多色流式细胞仪 Polychromatic flow cytometry
基于每个细胞类型相对独特的细胞表面或细胞内表达的物理特征和蛋白质,流式细胞法可以利用荧光染料偶联抗体识别和量化各种细胞类型,并且随着技术的进步,可以测量更多参数,比如荧光颜色和物理参数。
目前已有有了30 和 50 参数流式细胞仪,因此可以从同一样本中获得更多信息以进行进一步的高级分析。比如细胞群识别(例如FlowJo、FCS Express、WinMDI 和 CytoPaint)、聚类(例如DensVM、kmeans 和 mclust)、可视化(例如flowViz、ggCyto、RchyOptimyx、SPADE、Citrus)
质谱流式细胞术 CyTOF(Cytometry by time-of-flight)
CyTOF是将流式细胞术与质谱法相结合。与传统的流式细胞术相比,质谱流式细胞术用金属同位素而不是荧光团标记抗体,然后使用检测器对信号进行量化,该检测器至少检测 40 个参数,避免了光谱重叠的问题。(尽管理论上质量流式细胞术允许每个细胞检测最多 100 个参数,但处理速度和吞吐量受到离子速率的限制。)
CyTOF 已被验证为对肿瘤组织进行高维分析以进行探索性免疫分析和生物标志物发现的准确方法。
光谱流式细胞仪 Spectral flow cytometry
与质谱流式细胞术不同,光谱流式细胞仪仍然用荧光染料标记抗体,但用色散光学器件和测量全发射光谱的新型检测器代替了经典的光学器件和检测器。传统流式细胞仪和光谱流式细胞仪保持了相当好的兼容性,特别是在商业抗体的可用性方面,但更好地减轻了批次效应(例如光谱重叠),以提高效率。
用于研究空间结构的单细胞分析
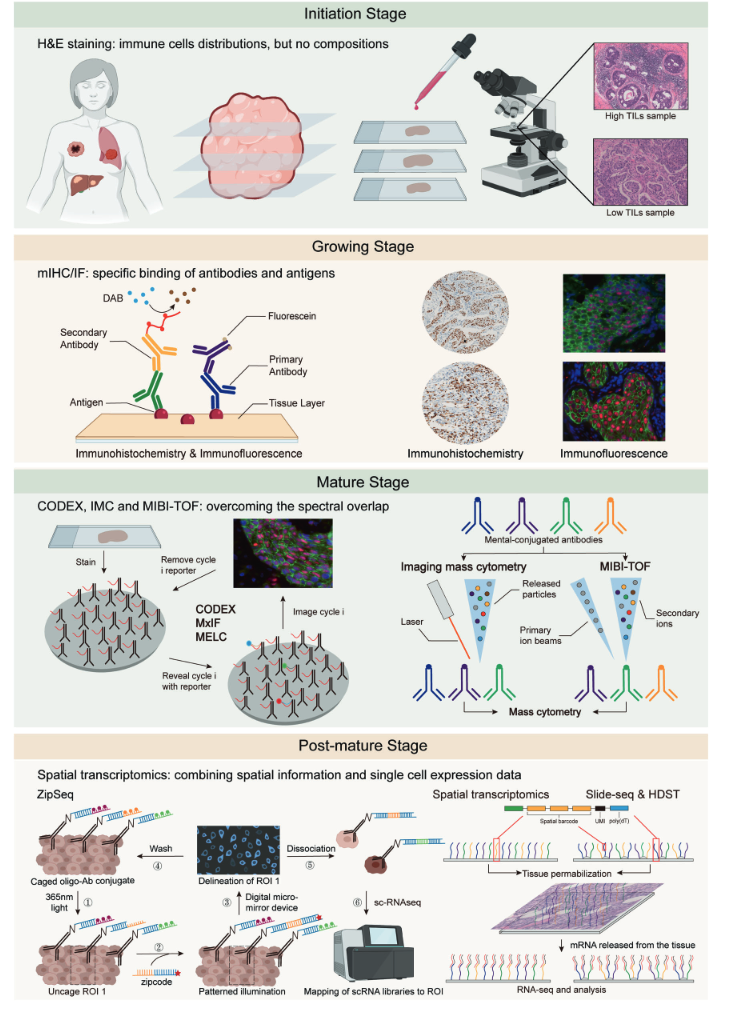
分为以下四个阶段:初始或新兴阶段、成长阶段、成熟阶段和后成熟阶段
起始阶段:H&E 染色
初始阶段,对 H&E 染色的肿瘤样本载玻片的组织成分进行显微镜分析,病理学家可以清楚地区分细胞的嗜碱细胞核和嗜酸细胞质,从而提供空间结构的图像。但没有特定biomarker情况下,研究者只能凭经验将细胞分成几个大的亚群,如成纤维细胞、肌肉细胞和炎症细胞,这并不适合研究 TIME 的空间结构。
成长阶段:mIHC & mIF
在成长期,免疫标记的发展显著改进了空间结构研究方法。IHC 和 IF 利用针对特定细胞中某些抗原的荧光染料或酶报告标记抗体来更精确地区分细胞类型。多重免疫组织化学/免疫荧光 (mIHC/IF) 能够同时检测单个切片上的多个标记,从而提高对空间结构的理解。不幸的是,与流式细胞术类似,mIHC/IF 仍然受到光谱重叠的限制。
成熟阶段:CODEX、IMC、MIBI-TOF
CODEX是一种多路细胞计数成像方法,用包含独特寡核苷酸序列的设计特定条形码代替荧光染料或酶报告基因。 多重荧光显微镜法 (MxIF) 和多表位配体制图 (MELC) 是另外两种使用类似于 CODEX 中的染料循环的技术,允许在单个样本中检测最多 100 种抗原。相比之下,MxIF 优于 MELC,因为它可以提供 FFPE 组织中多种分析物的定量,并将组织学染色与 DNA 荧光原位杂交 (FISH) 相结合。 成像质谱仪 (IMC) 是质谱仪的另一种扩展,类似于 IHC 和质谱仪的组合。使用激光烧蚀产生粒子,通过气体将这些粒子带到质谱流式细胞仪,然后在载玻片上生成感兴趣区域的高分辨率图像。IMC 保留了抗原特异性,并且可以同时提供 32 种蛋白质的空间分辨分析。 与mIHC/IF相比,MIBI-TOF利用二次离子质谱技术对标有同位素的抗体进行成像,最多可同时分析100个目标,准确度高、光谱重叠低。
成熟后阶段:空间转录组学
比如DBiT-seq和ZipSeq
免疫组学和人工智能
人工智能在癌症免疫研究中的技术进步主要涉及以下几个方面:
(1) 减轻人工识别病理切片免疫浸润的工作量; (2) 提供一种替代技术来识别人眼难以区分的免疫细胞亚群和空间结构; (3) 提供一种非侵入性方法来预测 TIME 的特定患者特征和对免疫疗法的反应。比如可以使用深度学习方法预测肿瘤抗原;放射组学图片与AI相结合。
最后附上一张免疫组学的发展趋势与未来方向:













