今天为大家带来的是一篇发表在《Ann Oncol》上的文章,题目是“Association between PD1 mRNA and response to anti-PD1 monotherapy across multiple cancer types”,影响因子:32.976。这本期刊今年的影响因子也是飞速飙升~本篇范文通过对多种癌症类型肿瘤样本中PD1基因的丰度,解释不同癌症类型抗PD1单药治疗后观察到的总有效率差异,以此来反应PD1基因与抗PD1单药治疗反应的关系。
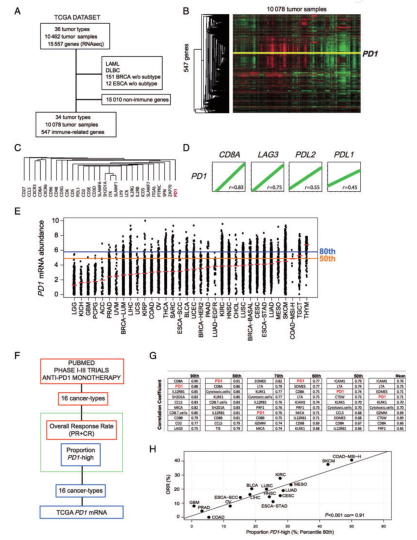
近年来,抗PD1药物已证明对各种肿瘤具有显着疗效,目前仍然没有明确的预测性生物标志物可用于疗效预测。基于的PD-L1检测有重要的局限性,如所用抗体的敏感性不同,以及在评分和切断测定时的主观性。因此,识别可重复应用的生物标志物来预测抗PD-1单药治疗的疗效可能具有临床价值。作者发现前期已经有两项研究评估了用抗PD1/PDL1治疗的各种实体瘤患者中免疫相关基因表达的相关性。在第一项研究中,Ayers等使用nCounter平台在19名接受pembrolizumab治疗的晚期黑色素瘤患者中开发了预测性“肿瘤炎症”特征。发现PD1不是该特征基因列表的一部分。并观察到GES评分低的肿瘤患者对抗PD1治疗无反应。在第二项研究中,Fehrenbacher等评估了一项多西紫杉醇或atezolizumab治疗的224例NSCLC患者发现使用Nimblegen平台测量的具有高T效应干扰素-c相关基因表达的患者使用atezolizumab改善了OS。对于范文,首先我们要明确研究目的就是更好地了解与抗PD-1抗体药物活性相关的生物学特征,并通过在大型泛癌数据集和抗PD1/PDL1治疗后的数据预测观察疗效的预测性生物标志物。以此发现抗PD1治疗后ORR最高的癌症类型是TMB最高的癌症类型。作者在前期已经报道了利用nCounter平台表达的免疫相关基因,包括PD-1,是可重复的,并与抗PD-1单药治疗65例晚期癌症患者的疗效相关。于是作者提出科学假设:肿瘤样本中PD-1 mRNA的丰度可能解释抗PD-1单药治疗癌症后观察到的总体应答率(ORR)的差异。通过科学假设,我们可以看出文章中肯定用到了临床试验,那就需要组织样本。同时,PD-L1在其他肿瘤和其他抗PD-1药物(如nivolumab)中未能发现其具有预测性。因此,有必要借助诸如nCounter这样已被报道具有高度可重复性的平台,在临床上实施稳健且可重复的基因组分析。范文最大的亮点就是将PD1基因丰度、活化的CD8 T细胞和抗PD1功效联系起来。研究通过来自TCGA代表34种不同癌症类型的10,078个肿瘤样本的RNASeqv2数据,分析了包括PD1在内的18个免疫相关基因签名和547个免疫相关基因。计算抗PD1单药治疗后每个基因/信号与文献中报道的ORR之间的相关性。为了将影像学发现转化为临床背景,作者使用nCounter平台分析了17种癌症类型的773个福尔马林固定石蜡包埋(FFPE)肿瘤样本中PD1 mRNA的表达。为了测试PD1基因、PDL1免疫组织化学(IHC)、间质肿瘤浸润淋巴细胞(sTILs)和ORR之间的直接关系,作者评估了一个独立的基于FFPE的数据集,该数据集包含117名接受抗PD1单一疗法治疗的晚期疾病患者。最后,在117例晚期疾病患者中,分析预先建立的基于FFPE的PD1 mRNA截止值与抗PD1疗效的相关性。TCGA中与表达相关的PD-1免疫相关基因
首先,作者合并了TCGA数据库中34种不同肿瘤的10078个样本的RNA序列数据(Fig.1A)。从15557个基因中选出包括PD-1在内的547个免疫相关基因(Fig.1B)。随后利用DAVID数据库分析PD-1的共表达基因,以r>0.80为限定值筛选了强相关的30个基因(包括CD3和CD8A),这些基因在CD8 T细胞活化等生物学过程中显著富集(P<0.001)(Fig.1C)。这与单基因分析结果一致,PD-1与T细胞活化的免疫相关基因表达特征(GES)强相关(r>0.80)。PD-1表达与其他免疫检查点抑制剂如LAG3(r=0.75)、PDL2(r=0.55)和PD-L1(r=0.45)之间的相关性较低(Fig.1D)。TCGA数据库PD-1在泛癌中的表达差异
研究发现34种肿瘤的PD-1表达在不同肿瘤类型之间和同一肿瘤类型之内的表达变异性很大.图中红线在每个cancertype表示值的表达式。作者将样本按照整个队列中PD-1的中位表达量进行排序,水平线表示50%和80%的PD-1表达量。例如,当以组合矩阵中第80百分点作为界定PD-1高表达与PD-1低表达的临界值时,每种肿瘤类型中PD-1高表达肿瘤的比例在0%~84%之间(Fig.1E)。免疫相关基因表达和抗PD-1抗体疗效
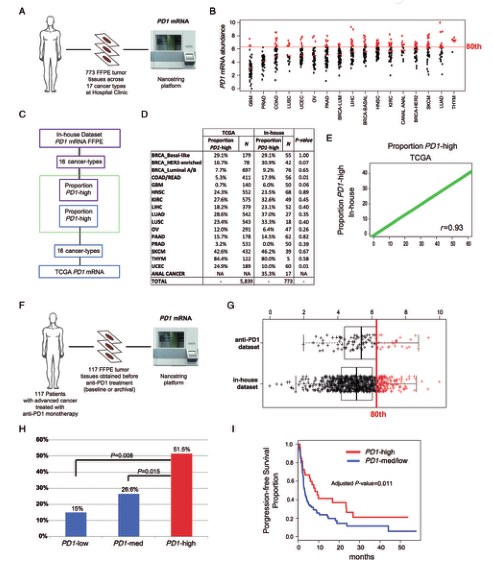
Fig.1F比较了每一种癌症类型中高PD-1比例进行分析的图以及抗PD-1单药治疗后报告的总体应答率(ORRs)。在PD-1平均表达最高的肿瘤类型中,接受抗PD-1单药治疗(如黑色素瘤)患者的ORR最高。在PD-1平均表达最低的肿瘤类型中,接受抗PD-1单药治疗(如胰腺癌)患者的ORR最低。这些数据表明,不同肿瘤类型之间和同一肿瘤类型之内的PD-1表达丰度可能与抗PD-1疗效有关。为了确定不同肿瘤类型中生物标记物高表达肿瘤的比例,作者在组合矩阵中评估了6种不同的临界值(即第50至第90百分点和平均值)。结果显示,在565个生物标记物中(即547个个体基因和18个GES),PD-1与ORR高度相关(r=0.74~0.91),并且与被评估的6个截止点的前三个生物标记物保持一致(Fig.1G)。在本研究中还描述了PD-1高百分比(80%)与以往文献报道的不同实体肿瘤抗PD-1单药治疗后ORR的相关性(Fig.1H)。二、肿瘤突变负荷(TMB)和抗PD-1抗体疗效相关性为了探讨PD-1 mRNA和TMB之间的关系,作者使用TCGA数据库中来自8792个肿瘤样本和31个肿瘤类型的PD-1 mRNA和TMB数据。在这个组合数据集中,PD-1 mRNA和TMB之间没有相关性(r=0.09)。然而,PD-1高表达肿瘤的TMB平均值(9.44)明显大于PD-1低表达肿瘤的TMB平均值(5.61;P<0.001)。这些计算机分析结果表明,与TMB相比,PD-1 mRNA可能是一个更好的抗PD-1疗效的预测指标。接下来,作者进行临床样本PD-1表达分析,利用临床773个代表17种肿瘤类型的组织样本,分析不同肿瘤类型的PD-1表达,并确定了第80%的表达值,该百分点定义了PD-1高表达与PD-1低表达的肿瘤(80%表达值=6.3)(Fig.2B)。为了比较了内部数据集和TCGA数据库(Fig.2C)之间每种癌症类型中PD-1高表达肿瘤的比例。在两个数据之间,16种肿瘤类型中15种的PD-1高表达肿瘤的比例没有显著差异(Fig.2D)。为了探讨PD-1表达与抗PD-1疗效的直接关系,作者以117例接受抗PD-1单药治疗的晚期肿瘤患者根据PD-1 mRNA预先确定的临界值,结果显示28.2%的样本被确定为PD-1高表达(Fig.2G)。与是否具有良好的临床疗效对比,以PD-1高表达肿瘤的ORR为51.5%,而其余的ORR则为23.8%,均具有显著统计学意义(Fig.2H)。进一步的PD-1 mRNA与其他生物标志物的相关性中作者选用的验证数据集包含84个可评估样本,发现PD-1 mRNA与sTILs这两个生物标志物之间的相关性系数r=0.53,表示相关性并不很强。从抗PD-1疗效的相关性来看,连续变量sTILs的表达与疗效不存在显著相关性,而PD-1作为一个连续变量与疗效显著相关。最后,作者基于PD1 mRNA的表达进行无进展生存分析(PFS)(Fig.2I)。我们明确本篇范文的目的就是更好地了解与抗PD-1抗体药物活性相关的生物学特征,并确定观察疗效的预测性生物标志物。目前,免疫组化检测PD-L1表达仍然是pembrolizumab治疗NSCLC唯一被认可的伴随诊断,但该生物标记物存在严重的技术局限。同时,PD-L1在其他肿瘤和其他抗PD-1药物(如nivolumab)中未能发现其具有预测性。因此,有必要借助诸如nCounter这样已被报道具有高度可重复性的平台,在临床上实施稳健且可重复的基因组分析。本文围绕着“肿瘤样本中PD-1 mRNA的丰度可能解释抗PD-1单药治疗癌症后观察到的总体应答率(ORR)的差异”这一问题展开生物信息学分析。也就是说范文主要想通过PD-1 mRNA表达水平预测不同类型肿瘤抗PD-1单药治疗的预后,是一篇预后类型的生信文章。创新点就在于抗PD-1单药治疗与肿瘤适应性免疫反应间的关联。作者比较自己团队来自不同的研究队列内部泛癌数据库样本和TCGA数据库(早期疾病>90%)之间PD-1高表达的比例,结果是相似的。这一结果表明,在同一类型肿瘤和不同类型肿瘤之间的T细胞活化量是一个基于人群的稳定现象。除基因表达外,也出现了其他抗PD-1治疗敏感性的遗传生物标志物。其中最有潜力的是肿瘤突变负荷(TMB)。抗PD-1治疗后ORR最高的肿瘤类型实际上也是TMB最高的肿瘤类型。并分析之前的研究,有观察到TMB与其疗效直接相关。然而,TMB是否能直接预测其他肿瘤类型的抗PD-1治疗疗效还需要证明。此外,还需要进一步的研究来确定TMB的分析有效性和临床实用性。TCGA数据与其他研究中的ORR进行计算机分析比较在临床试验之外治疗的晚期肿瘤患者(主要是黑色素瘤和NSCLC)的有限和异质性数据集中,评估了PD-1表达和抗PD-1疗效的直接关联,并证实基于PD-1表达的抗PD-1的疗效梯度。总之,作者的研究通过使用PD-1 mRNA表达水平来识别预先存在且稳定的适应性免疫反应,可以预测不同类型肿瘤抗PD-1单药治疗的预后。好了,这篇30分+的TCGA数据库纯生信高分文献就解读到这里了,后台回复“1231”获取范文一起学习吧,下期再见了,拜拜!
作者:菠小萝,文章来源挑圈联盟
参考文献
[1]Prat A, Navarro A, Paré L et al. Immune-Related Gene Expression Profiling After PD-1 Blockade in Non–Small Cell Lung Carcinoma, Head and Neck Squamous Cell Carcinoma, and Melanoma. Cancer Research 2017; 77: 3540-3550.[2]Pare, L., et al., Association between PD-1 mRNA and response to anti-PD-1 monotherapy across multiple cancer types. Ann Oncol, 2018. 29(10): p. 2121-2128.