微生物培养基的前世
微生物学家使用琼脂培养基已有120多年的历史。在1880年,著名的微生物学家科赫(提出病原微生物科赫氏法则)发明了微生物学领域这一革命性技术: 用固体培养基进行的细菌纯培养。这种方法解决了用液体培养基培养细菌时,各种细菌混合生长在一起而难以分离的难题。在固体培养基表面,细菌的单克隆可以固定地在培养基的某一点上生长,并不断分裂,形成一个个可见的菌落,然后研究者可以把这些菌落很方便地移种到其它的培养基上或接种到动物体内。正是这种微生物纯培养方法的发明,使得微生物学研究发生了革命性的变化。微生物学也完成了形态观察现象描述走向了实验科学的跨越。微生物固体培养基的发明,对后来病原微生物的分离培养,疫苗以及青霉素的抗生素的研制上也作出了突出的贡献。
随着测序等技术的发展,人们对微生物多样性的认识也越来越全面,并发现有很多环境中存在的微生物并不能在固体培养基上生长。长期以来,研究人员一直试图找出限制微生物生长的因素,希望从环境样品中尽可能多的分离培养高多样性以及新微生物物种。目前比较广泛应用的方法包括:微生物的原位培养,微流控技术,以及配制不同营养成分的培养基以更好地让微生物们在培养基上生长等。但是在实践中,研究者发现总的微生物数量和可培养的微生物之间经常存在着差异,一般我们把这种现象叫“平板计数异常”。有研究者估计只有1%的土壤细菌才能被培养,并且我们还需要准备成百上千种不同的培养基,来应对不同微生物的生长需求。
为什么大多数的微生物如此难培养呢?
部分微生物生长缓慢
在培养基上不形成克隆
它们需要一些未知的养分或者生长因子
依赖其它微生物或者宿主细胞共生
产生对自身作用的毒素
部分微生物是寡营养类型,高营养会致死
它们在休眠期
它们需要持续供给生长底物
但即使这样,依靠稀释涂平板方法获得微生物类群种类还是比较低,为什么许多微生物不在琼脂培养基上生长呢?
过氧化氢的产生导致许多微生物不能生长
研究者发现,当过氧化氢酶或丙酮酸盐添加到培养基中时,从琼脂平板上分离获得的微生物多样性显著增加,这表明表明自由基的氧化作用能抑制特定类群的微生物的生长。
日本科学家Kamagata发现,我们所有人在配制琼脂培养基过程中都忽略了一个隐藏的陷阱:那就是当磷酸盐与琼脂放在一起进行高压蒸汽灭菌时会产生产生大量的H2O2,而这些H2O2对很多类群的微生物具有强烈的毒害作用。所以与磷酸盐混合灭菌的琼脂培养基得到的微生物菌落总数总是显著低于显著低于在磷酸盐和琼脂单独灭菌的的琼脂平板。这里有人可能会说,我天天用琼脂与磷酸盐混合在一起高压灭菌,为什么我的大肠杆菌还是好好的活着呢?这是因为大肠杆菌非常皮实,抗自由基氧化能力非常强,正因为它这种好养的特性,它也理所应当的成为了模式生物。然而大部分环境中的微生物就没有大肠杆菌这么皮实了,培养基中高浓度H2O2已经足够将他们杀死。所以当你想从环境中分离多样性足够高的物种时,除了要考虑使用不同配方的培养基以及培养条件,你还需要注意在高温灭菌时不能把磷酸盐和琼脂放在一起,而是分别单独灭菌后再混合。
实验设计
为了研究这个问题日本科学家选用了首次从Gemmatimonas aurantiaca这个门中分离的一株菌T-27T进行实验。这个门的细菌在琼脂培养基上生长的极其缓慢或不能生长,所以多年以来一直不能在实验室中被培养。但作者偶然发现这株菌在冷结胶( gellan gum) 培养基上长得非常好,而这个冷结胶培养基与琼脂培养基唯一的区别就是使用的胶凝剂成分不同。因此作者怀疑琼脂糖与培养基中其它营养组分相互作用产生的物质抑制T-27T菌株的生长。为了验证他的假设,作者在准备琼脂培养基时分别采用了两种不同灭菌方法:第一种是磷酸盐和琼脂分别高压蒸汽灭菌(PS法,P为磷酸盐,S为单独)或磷酸盐和琼脂一起高压蒸汽灭菌法(PT法,T为共同蒸压)。然后作者在这些培养基中测量H2O2浓度,以测试活性氧(ROS)是否抑制T-27T菌株生长。此外作者还从三种不同环境来源的样品(土壤、沉积物和水)进行了微生物的分离培养测试,以验证不同灭菌方法对分离微生物多样性差异造成的影响。
具体实验方法
首先将G. aurantiaca T-27T菌在TYG液体培养基上摇瓶培养。然后设置不同浓度梯度的磷酸盐用于培养基配制。配制培养基时分成把磷酸盐和琼脂混合灭菌和把琼脂和磷酸盐分开灭菌两种方式。然后作者统计了该菌在不同培养基上的生长数目,以及不同培养基上的H2O2含量。
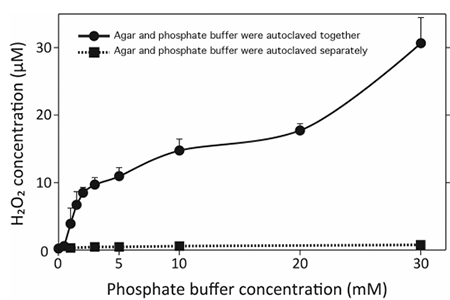
图1. 琼脂与磷酸盐一起或分开灭菌后,H2O2的浓度变化。从图中可以看到当琼脂和磷酸盐一起灭菌时,H2O2的浓度随着磷酸盐浓度的增加而产生的。而将琼脂和磷酸盐单独灭菌的培养基中H2O2的浓度接近于零并保持不变。
从下图1可以看出琼脂和磷酸盐分别进行高压蒸汽灭菌与同时进行高压蒸汽灭菌时,在固体培养基上形成的菌落数量有明显差异(图1A和B)。我们看到在不添加磷酸盐的对照板中也能看到生长(图1C),说明培养基中的其它营养成分含有足够的磷酸盐,可以供T-27T菌的生长。相反,当磷酸盐和琼脂一起高压蒸汽灭菌时,在不同浓度的磷酸盐培养基中,菌落的数量有显著的差异。如图A所示在0.5 mM磷酸盐(230 CFU)浓度的培养基上菌落仍然大量存在,而在1mm磷酸盐平板(100 CFU)上菌落数量有所减少。当磷酸盐浓度达到1.5 mM以上(0 CFU)时则完全没有任何菌落在培养基上生成。而最后将过氧化氢酶添加到磷酸盐和琼脂混合灭菌的培养基中,可以看到菌落重新在平板上大量生长,这说明磷酸盐和琼脂在一起高温灭菌时产生的过氧化氢是抑制微生物生长的最主要因素。

图2. 不同灭菌方法制备培养基对T-27T菌落形成的抑制作用。
A图表示不同浓度磷酸盐和琼脂一起灭菌后T-27T生长情况
B图表示不同浓度磷酸盐与琼脂单独灭菌再混合的T-27T生长情况
C图表示不添加磷酸盐的的T-27T生长情况
D图表示表示最高浓度磷酸盐和琼脂一起灭菌后再添加过氧化氢酶后的T-27T生长情况,最高浓度磷酸盐和琼脂一起灭菌作为对照。
三种不同环境样品分离培养实验
作者准备了PT(所有组分混合灭菌), PS(组分分开灭菌后混合), and PW (培养基中不含磷酸盐)三种培养基。然后作者用这三种培养基对来自土壤,沉积物以及河流的环境样品进行细菌稀释涂平板实验。由于这些环境的差异性,在每个来源的三份样本中形成的CFU的数量是高度可变的,特别是对于河流水样。由于细菌分布的不均匀性,水样的变化很大所以造成不同重复之间细菌差异的结果较大。而在PT、PS、PW三种平板上,在PT平板上形成CFU的数量最少。从沉积物和土壤样品中可以看到,PT平板上形成的细菌CFU的数量几乎比PS平板上形成的细菌CFU数量低一个数量级。这表明高浓度的磷酸盐不会抑制菌落的形成,但是当琼脂和磷酸盐一起高压蒸汽灭菌时会发生反应产生H2O2从而抑制微生物菌落的形成。在大多数样品中,PW培养基上CFU的数量与PS培养基上CFU的数量相近或高于PS培养基上CFU的数量。这些结果表明,培养基中其它营养成分中所含有的微量的磷酸已经足够微生物在在琼脂培养基上生长并形成菌落。并且未放在一起高温灭菌的磷酸盐与琼脂不相互作用,不会抑制菌落的生长。
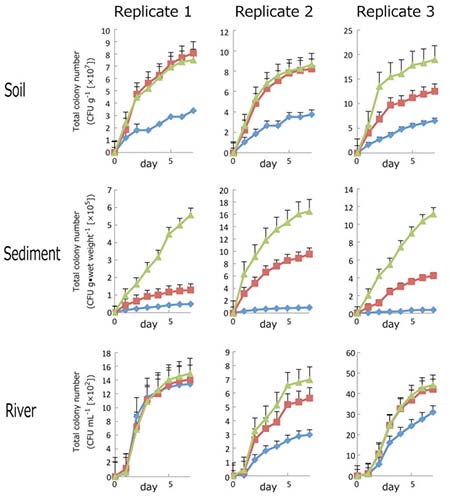
图3:三种环境来源(土壤、泥沙和河水)的菌落总数;
在三个不同的介质(蓝色宝石状曲线代表琼脂和磷酸盐混合灭菌的 PT培养基; 红色正方形代表琼脂和磷酸盐分开灭菌的PS培养基; 三角形代表不添加磷酸盐的PW培养基)。对PT、PS、PW培养基培养7天并进行CFU计数。图中展示的是在2到5个平板上形成30到300个菌落的平均CFU计数结果。如果菌落在整个培养基上过度生长,则培养基被排除在菌落计数之外。误差条表示从两个板到五个板计算的平均标准误差。
非培养高通量测序与分离培养结果比较
通过454高通量测序的OTU注释结果显示,在土壤中有40个不同细菌门,在沉积物中有56个不同细菌门,在河水中有53个不同细菌门,这比分离培养得到的6个门(土壤中有6个门,沉积物中有5个门,河流中有6个门)的微生物多样性高很多。在所有通过高通量测序获得的60个不同的细菌门中,只有17个门的序列相对丰度高于1%。此外作者还发现当把样品放在甘油中然后保存在-80℃后,样品中的稀有类群不能在培养基上分离培养了。通过β多样性分析发现,当使用Bray-Curtis距离时,高通量测序的样品和分离培养方法获得的在主坐标一轴上显著被分开,在分离培养的样品中,不同来源的样品在分组内部的微生物构成具有一定的系统发育关系。
图4. 利用PT、PS、PW培养基和454高通量测序法,对河流、沉积物和土壤样品中微生物相对丰度比较结果图。所有以分离菌株以及高通量测序相对丰度大于1%的序列都包括其中。高通量测序获得多的另外40个门被划分到其它门中。
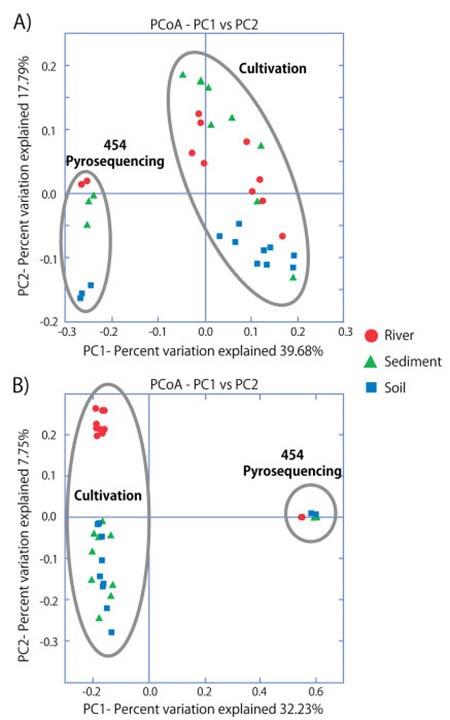
图5. 利用PT、PS和PW培养基从河流、沉积物和土壤样品中分离物的Beta多样性分析。
A)将数据稀释抽平到50个OTUs然后利用欧式距离(Bray-Curtis)进行多样性计算。
B)将数据稀释抽平到50个OTUs然后利用非加权的UniFrac对系统发育距离进行多样性分析。
总结
本研究中作者发现对培养基配制时,简单的将琼脂和磷酸盐分开灭菌,就可以增加一种难以培养的G. aurantiaca的培养成功率,并且能显著增加从各种环境来源分离的细菌多样性。活性氧是已知的许多细菌生长的抑制剂,无论是从培养基中去除磷酸盐(PW),还是将磷酸盐和琼脂分别高压蒸汽(PS),得到的CFU是PT培养基的50倍。琼脂与磷酸盐放在一起高压蒸汽灭菌时产生的H2O2是抑制某些类群微生物生长的一个重要因素。所以在做微生物分离培养的你,在下次配培养基时一定要记得把含磷酸盐的物质和琼脂分开进行灭菌。这样,也许你一直想分到,而没得到的菌株就能被你成功的分离培养出来啦!随后,作者又发表了两篇论文揭示了琼脂中H2O2形成的机制。他证明了H2O2的生成是pH依赖性的:H2O2在高浓度碱性或中性磷酸盐缓冲液中生成,而在酸性缓冲液中是不生成。并且培养基溶液中的铵离子会显著增加H2O2的生成量,从而导致培养基中更多H2O2的产生。感兴趣的同学可以阅读参考文献中附录文章!
References:
Tanaka, T., Kawasaki, K., Daimon, S., Kitagawa, W., Yamamoto, K., Tamaki, H., … & Kamagata, Y. (2014). A hidden pitfall in the preparation of agar media undermines microorganism cultivability. Applied and environmental microbiology, 80(24), 7659-7666.
Kawasaki, K., & Kamagata, Y. (2017). Phosphate-Catalyzed Hydrogen Peroxide Formation from Agar, Gellan, and κ-Carrageenan and Recovery of Microorganisms Cultivability by Catalase and Pyruvate. Applied and environmental microbiology, AEM-01366.
Kato, S., Yamagishi, A., Daimon, S., Kawasaki, K., Tamaki, H., Kitagawa, W., … & Kamagata, Y. (2018). Isolation of Previously Uncultured Slow-Growing Bacteria by Using a Simple Modification in the Preparation of Agar Media. Appl. Environ. Microbiol., 84(19), e00807-18.













