文章信息
文章题目:Integrated pseudotime analysis of human pre-implantation embryo single-cell transcriptomes reveals the dynamics of lineage specification
发表期刊:Cell Stem Cell
日期:2021年5月17日
DOI:https://doi.org/10.1016/j.stem.2021.04.027

跨物种早期胚胎发育研究比较详尽的文献。
亮点:
揭示了在囊胚B2-B3期已出现明显TE/Epi信号 IFI16在ICM中广泛表达,且在着床后仅在epiblast中表达 NR2F2从晚期囊胚TE极开始表达,随后在整个TE中表达 分析表明PrE来源于晚期囊胚中的EPI。
SUMMARY
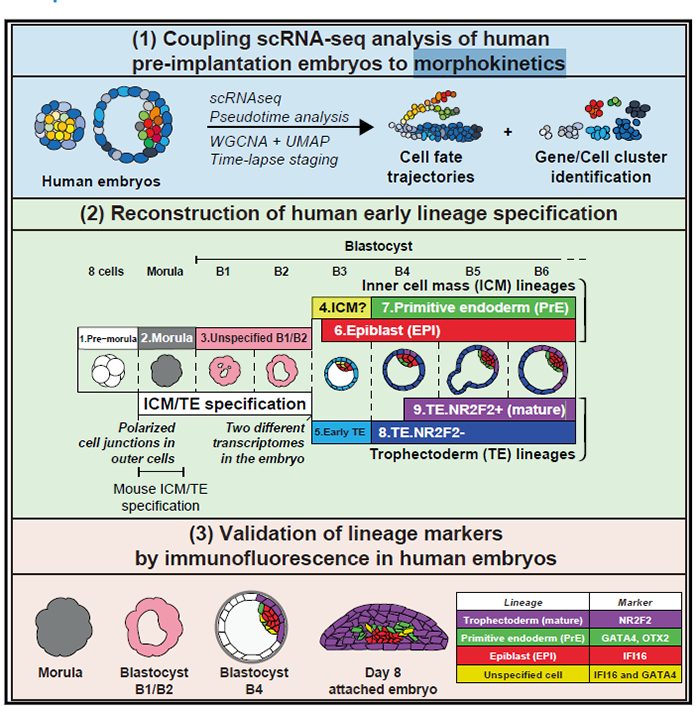
作者采用了scRNA-seq 利用拟时分析重构了人和鼠的早期胚胎发育。结合已知胚胎信息的延时成像分析,作者提供了一个完整有序且连续的人早期胚胎发育转录动态变化。主要发现有:第一次谱系分离(TE/ICM)出现在囊胚扩张前的 B2-B3 时期;IFI16 和GATA4 在第二次谱系分离(Epiblast/PrE)时逐渐互斥;NR2F2可以表征TE成熟,从囊胚极化侧开始表达,着床后在所有TE中表达;确定了人早期胚胎发育事件的准确事件,鉴定了转录hallmarks和细胞命运markers。
INTRODUCTION
生物界一直有个问题,即人早期胚胎细胞命运特化是如何发生的。之前我们只有胚胎形态学上的的信息,随着胚胎形态的变化,干性EPI和干性TE建立。人胚多能性来源于着床前胚胎,故更好地理解早期胚胎发育对干细胞研究很有影响,对不孕不育治疗和IVF亦如是。
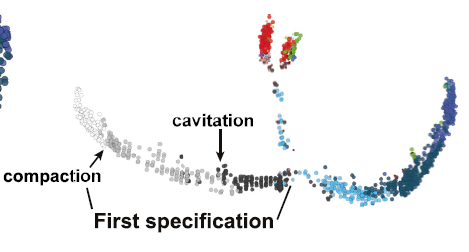
着床前胚胎发生的主要形态变化是致密化和空腔化。致密化的特征是在8细胞后,细胞间形成紧密连接;空腔化是通过液体输入在胚胎内形成一个空腔。致密化和空腔化对应不同的谱系特化。小鼠上的研究表明,致密化后桑葚胚外部细胞极化对谱系特化是必要的;空腔化对TE发育亦是必要的。人胚是否有相似之处尚不明确,今儿我们就给他整明白了。
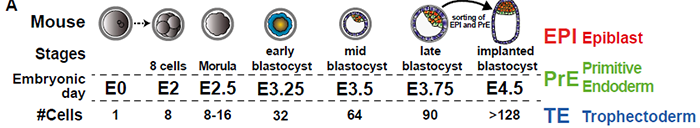
小鼠谱系规范是由两个连续的事件驱动的。桑葚胚发生的第一个细胞命运决定事件将外层TE细胞从ICM 分离。随后在囊胚中,ICM经历第二次谱系分离,形成EPI和PrE,分别是胚胎本身和卵黄囊的前体。这一连续事件在人胚胎中是否保守仍存疑。一方面,近期研究表明,在人胚中TE/PrE/EPI谱系建立是同时发生的,而非小鼠那样的两步模型;另一方面,整合多个早期胚胎scRNA-seq分析发现,人存在不同于EPI和PrE的早期ICM阶段,这意味着具有两步模型,但亦不能排除同期建立谱系的存在。
在小鼠中,第一次细胞命运决定,即TE从ICM中分离发生在桑葚胚期,由YAP/TEAD4/CDX2 信号轴介导。一开始,外层细胞开始极化并在顶端膜表达Hippo通路调控因子 aPKC 和 Amot。在外层极化细胞中,Hippo通路调控Yap1转入细胞核中,在核内与TEAD4结合。Yap/Tead4 复合体激活TE 命运决定因子,如Cdx2,非极化部分参与ICM 命运调控。
最近研究表明,极化/Hippo通路参与调控了人TE发生。不过关于TE的发育知之甚少。CDX2在空腔化后表达,因此不会像鼠一样驱动TE命运决定。在人TE上仅有以下markers是已知的:GATA3/LAMA1LAMA3/KRT7 发生在囊胚附植后;GATA2 发生在B2/3 囊胚后;CCR7发生在极化TE细胞中;此外,囊胚和子宫内膜互作的分子事件仍难以搞明白。人囊胚由极化一侧植入子宫内膜表面上皮,这表明该过程分子事件发生在囊胚极化TE侧,但分子机制尚不清楚。
小鼠第二次细胞命运决定发生在囊胚期,该过程由Nanog/Fgf4/Gata6 信号轴决定。在EPI细胞中,Nanog 决定Fgf4分泌水平,Fgf4诱导Gata6表达;反之,Gata6抑制Nanog,使细胞走向PrE。在人胚中,PrE中的GATA6在着床时特异表达,小鼠则发生在90细胞囊胚期;此外,FGF信号通路似乎不能调节人EPI/PrE的形成。关于人着床前胚胎的基因表达图谱,scRNA-seq已经详细提供,但仍不清楚细胞命运在何时何地是否被决定。人胚中TE/EPI/PrE 的谱系关系仍有待阐明。
本研究明确定义了小鼠和人早期胚胎发育过程中的基因表达和细胞命运决定的动力学事件。将形态学与分子事件相结合,突出了人鼠胚胎的异同。最后,定义了人TE/EPI/PrE 的蛋白markers。
RESULTS
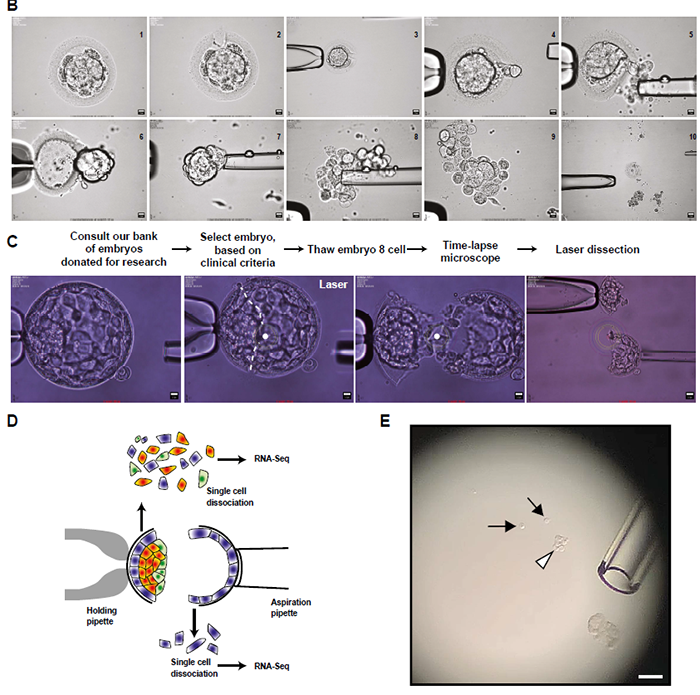
Designing an experimental approach coupling fine staging with scRNA-seq analysis
比较人鼠发育的主要困难之一是发育时序的不对应和每个物种发育阶段的特异性。小鼠中,胚胎天数可以与形态和分子事件精密对应;而人in vitro胚胎的培养时间和形态并不对应。故目前在人胚中只能以形态学为发育金标准。以dpf5 为例,这天胚胎从早期囊胚(B1/2)发育到了囊胚(B3)和扩张囊胚(B4)。
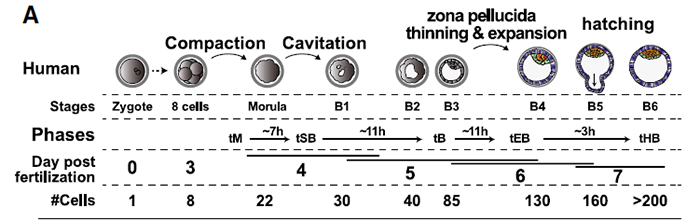
拟时分析似乎是研究谱系规范和分子事件的好方法。本文采用Monocle2来生成细胞发育命运轨迹,鉴定出最可能的转录特征。为了鉴定谱系特征,此处进行测cell cluster。最后采用延时监测和透明带厚度进行仔细分期,并根据临床标准进行分级,从而将形态学与发育事件联系起来。
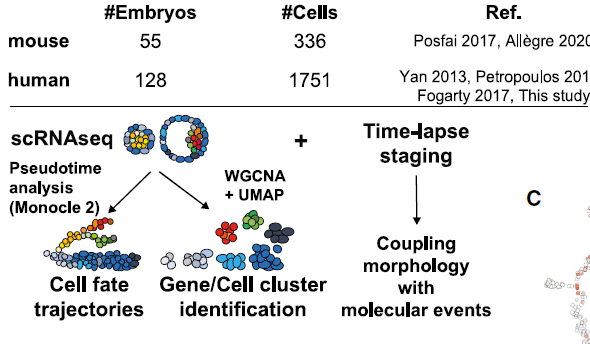
Transcriptomic pseudotime analysis of mouse and human pre-implantation development
此处首先分析了小鼠着床前胚胎16细胞桑葚胚到90细胞囊胚的两个数据集。拟时分析鉴定了一个共同的祖细胞pool,随后产生了两个分支:
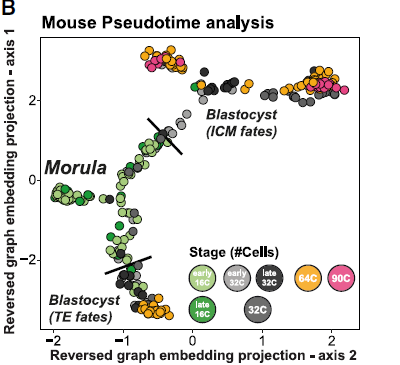
拟时的值表明了祖细胞的转录水平变化:
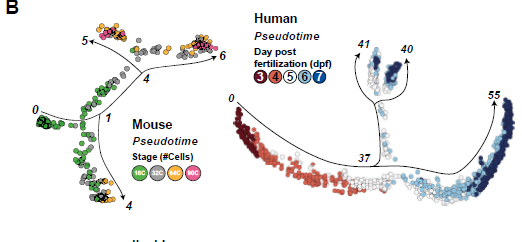
将发育阶段注释到拟时轨迹上,确定了初始未定义的分支主要由16细胞桑葚胚组成。晚期16细胞桑葚胚处于细胞命运决定第一个分叉点。随后,早期32细胞桑葚胚和晚期32细胞桑葚胚在ICM和TE分化方向均有分布。64细胞和90细胞囊胚处于拟时分析分支顶端。Sox2、Cdx2和Sox17可以分别鉴定出EPI/TE/PrE。拟时分析可以重建小鼠早期胚胎发育路径,包括意料中的TE/ICM分支点和EPI/PrE分支:

随后作者研究了人从桑葚胚到B5囊胚(共150 cells)的25个胚胎产生的scRNA-seq数据。将该数据与已发表的数据整合分析,得到一个包含1751个细胞的atlas。拟时分析显示共有五个分支,每个分支至少包含来源于俩数据集的细胞:
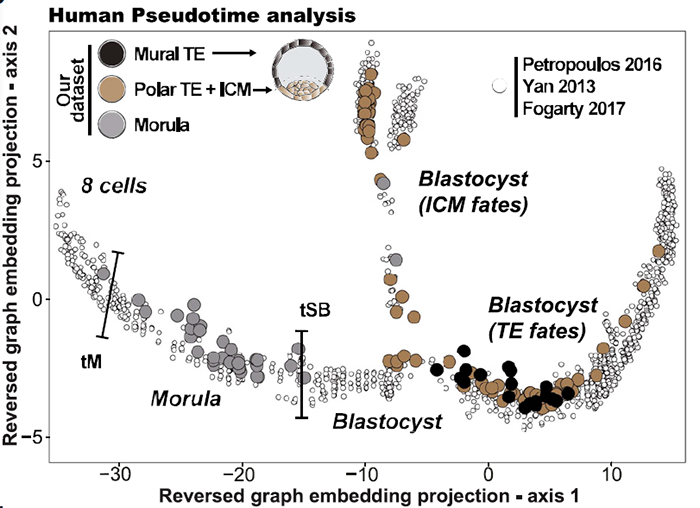
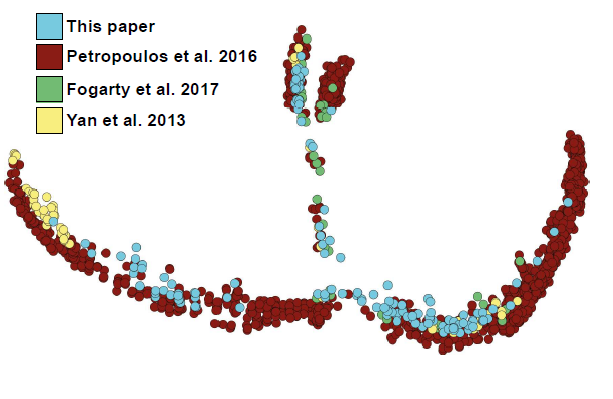
结合延时显微镜拍摄的结果,可以将发育阶段联系起来。由于囊胚是由激光切割分离了外层TE和极化TE/ICM,故也可以将位置信息对应到数据上:
桑葚胚细胞处于第一分支的中间位置,TE分支向右延伸,对TF进行分析发现,KLF17富集于EPI,SOX17富集于PrE,GATA2富集于TE:
为了将发育阶段和分子事件相结合,作者对来源于同一胚胎的所有细胞都进行了分析,随后根据拟时位置对胚胎进行重组:
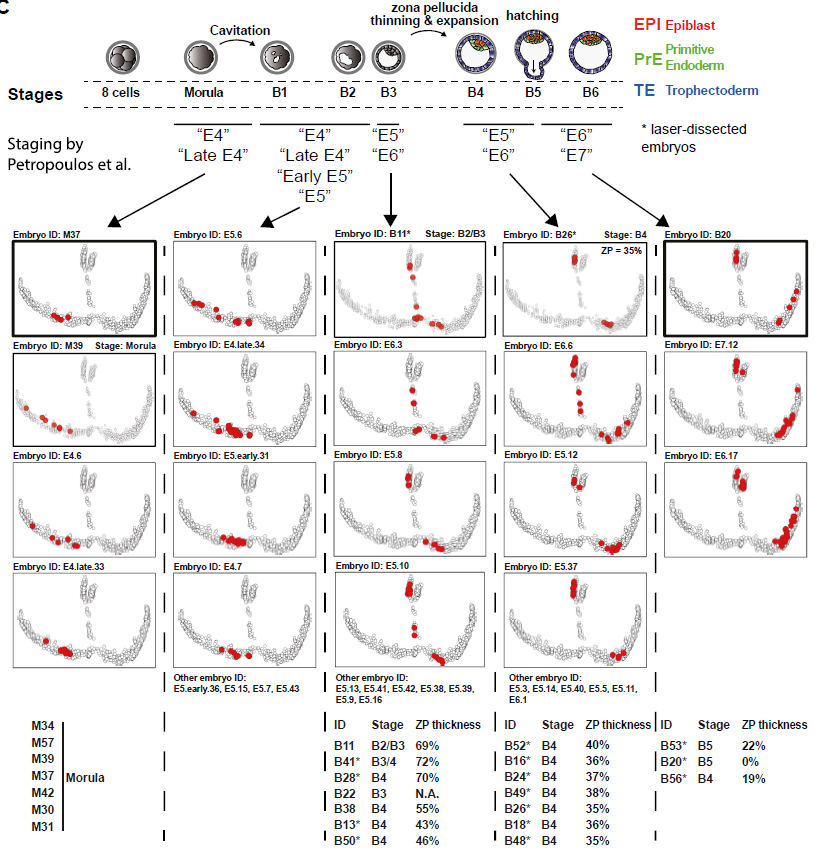
结果显示,人囊胚空腔化开始后,TE/ICM 细胞在B2-B3阶段在转录水平上变得明显不同:
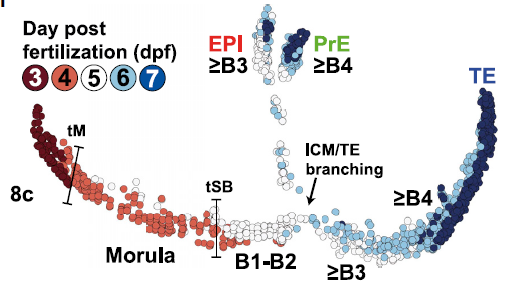
这一结果与小鼠明显不同:小鼠中ICM/TE间的分支出现得更早,介于16-32细胞阶段(见第五图)。
Defining the hierarchy of gene expression and lineage signature during human pre-implantation development
随后进行每个细胞的谱系归类。拟时分析特适合分析着床前胚胎发育的动态特征。采用WGCNA鉴定不同发育阶段与谱系相关的基因表达签名。模块的活性或抑制性可以概括为模块特征基因表达值的的线性组合。为了获得转录特征的精确映射,作者采用来自基因模块的特征基因作features输入,通过UMAP进行降维,再根据UMAP上的位置进行聚类,产生了8个cluster代表不同的谱系和stage;并将位于cluster间的细胞定义为:“undefined or intermediates”:
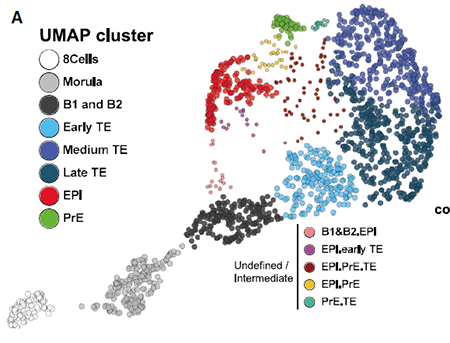
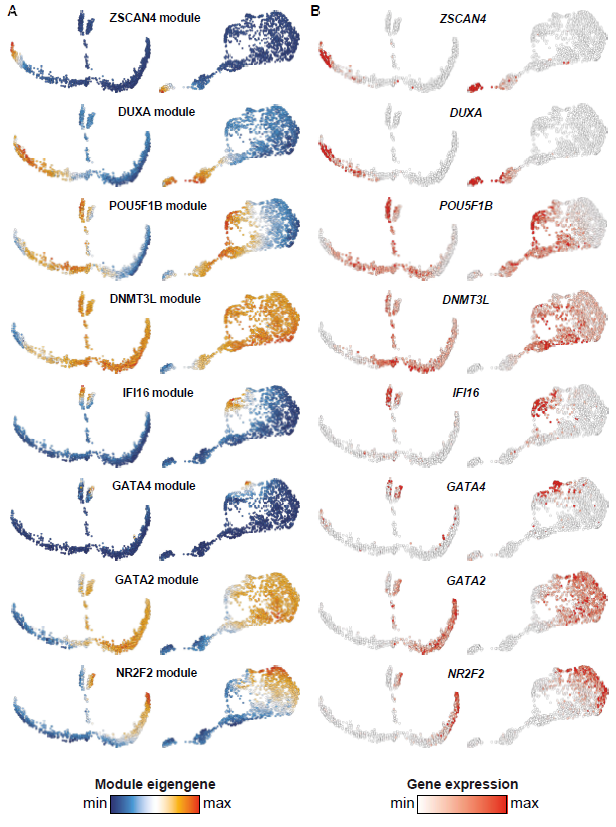
模块特征基因以无监督的方式对EPI/PrE/TE细胞进行分类。与前人进行多轮PCA的方法相比,本文的方法给出了一个更加保守的PrE鉴别方法;一个精细的细胞命运与发育阶段关联,同时识别出了“undefined or intermediates”细胞,限制了噪音的影响:

Stirparo et al. 将E5 中非TE细胞定义为ICM。他们鉴定为ICM的细胞大多位于本文EPI细胞群中:

本文并未发现一个可以被严格确定为ICM的cluster。不过,作者分析了三个未定义的cluster,将TE又细分为三个亚群:
故而本研究确定了人着床前胚胎发育的分子事件,提供了一个可复现的、完善的细胞命运谱系注释。
具体而言,为了进一步分析基因表达的时间动态,在前人的结果上,作者将基因模块与聚类cluster进行了匹配,并以八个模块中的代表性基因命名该模块。三个未定义cluster通过以下模块定义:
1)ZSCAN4 模块,仅在8细胞期表达; 2)POU5F1B 模块的发生,DUXA模块定位于桑葚胚细胞; 3)ZSCAN4 模块缺乏,DUXA模块消退,POU5F1B/DNMT3L 模块崛起则代表了早期囊胚。
至于TE细胞,上文讲到可以分为三个cluster,分别为:
1)表达GATA2/POU5F1B/DNMT3L模块的cluster,称之为早期TE; 2)表达GATA2但不表达POU5F1模块的cluster; 3)表达GATA2和NR2F2模块。
以上这些模块共同定义了早期胚胎发育的基因动态变化特征。
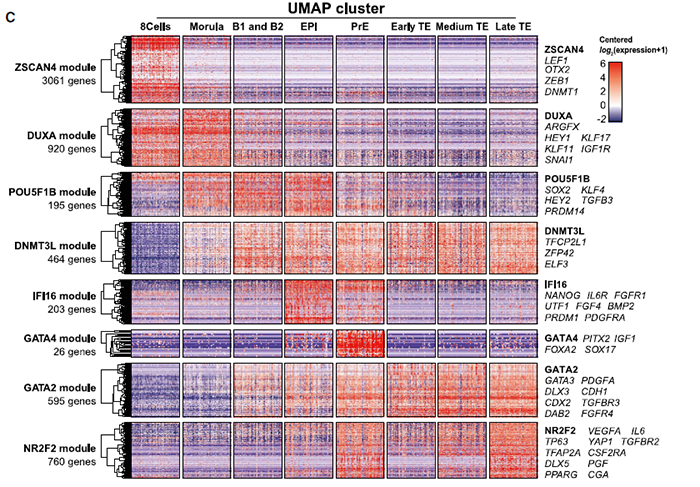
cluster内模块的pattern和拟时信息表明了基因在每个模块的潜在作用。某些模块与细胞命运无关,但可以反应胚胎发育的整体变化。例如ZSCAN4和DUXA模块在八细胞和桑葚胚期与合子激活有关,而DNMT3L 在囊胚期所有细胞中均出现,与某些表观因子一起,与人着床前胚胎发育和代谢通路中的甲基化动态一致。
表观通路基因表达情况
另一方面,某些模块则与细胞命运相关,按顺序表达。含有多能性基因的POU5F1B模块首先在桑葚胚和B1/B2囊胚的所有细胞中表达,随后在EPI维持,在PrE和TE中减少。因此,POU5F1B模块是首个从整体到特定某谱系表达的模块。而其他模块则仅与特定谱系相关。例如IFI16 模块与EPI的发育和维持有关;GATA4模块与PrE相关;GATA2模块与早中晚期TE相关;NR2F2 模块与晚期TE 相关。谱系特异性模块中的几个基因表表达与目前对发育动力学的理解一致,如IFI16模块包含NANOG, 与POU5F1B 模块在B4囊胚期重叠;GATA4模块包含了PrE命运调控因子SOX17和FOXA2。通过拟时分析和基因相关性分析可以将着床前胚胎的发育状态分级,并与已知的发育阶段关联。所有的注释和表达谱可以通过以下链接找到:
https://bird2cluster.univ-nantes.fr/demo/PseudoTimeUI/index.html
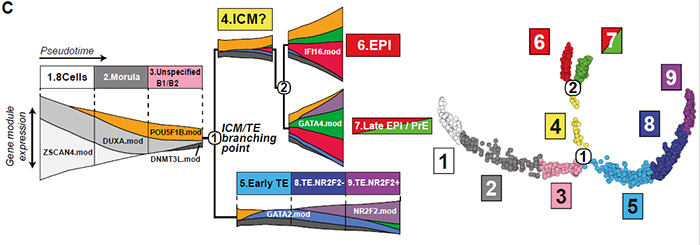
模块与发育阶段关联
Human morula and B1/B2 blastocyst cells show heterogeneity
拟时分析结合延时成像发现人胚胎细胞在空腔化后转录发生变化。为完善这一结论,基于所有胚胎的拟时分析结果,作者探讨了每个胚胎内聚类可能存在的转录异质性。首先定义每个胚胎内的细胞只能属于一个cluster(即不可以在两个cluster内出现同一个胚胎来源的细胞),随后分析了每个cluster的拟时轨迹,并将之注释到胚胎信息上。cluster1 跨越了一个相对较短的拟时距离,仅包含3-dpf胚胎;ckuster K3和K4 有最长的拟时距离;cluster K3 几乎包含了所有4-dpf胚胎,这表明桑葚胚期。某些细胞可能发育的更快。为了测试位于第一个拟时分支前的桑葚胚是否已启动了偏向命运决定的转录程序,此处引入了RNA速率分析。小鼠结果显示,细胞速率倾向于ICM/TE,表明在16细胞阶段,小鼠细胞已经表现出命运决定倾向,但转录差异在32细胞胚胎中才可见。同样在人胚中RNA速率显示,尽管第一分支前细胞的 mRNA表达谱相似,但是亦出现了ICM/TE的命运选择,这一结果与小鼠一致。将之映射到UMAPB1/B2群,也可以观测到这一点。人胚胎异质性似乎是在桑葚胚期建立的,但内外细胞的转录差异直到B3囊胚才开始出现。
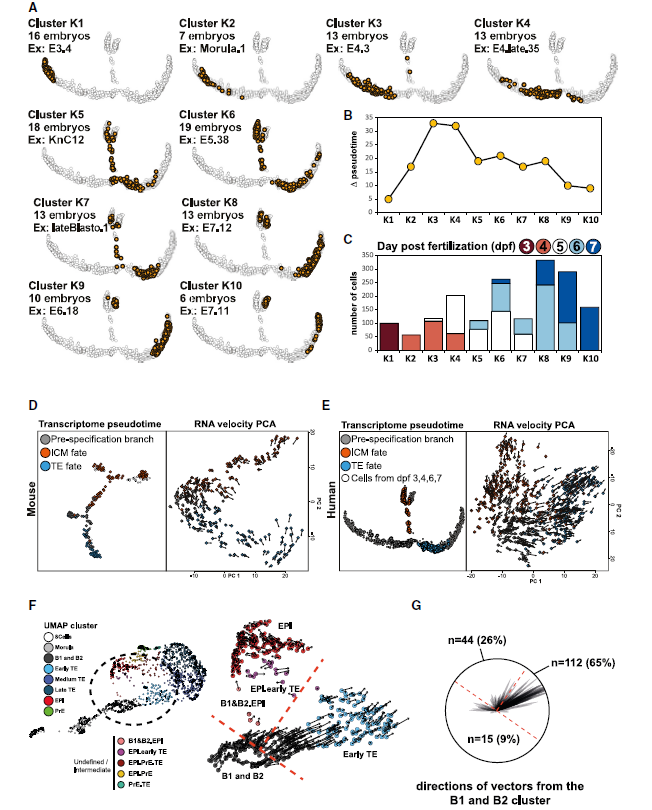
Identification of markers of compaction and cavitation during human pre-implantation development
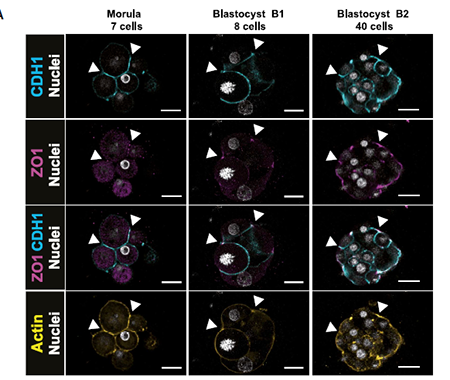
桑葚胚期细胞致密化需要建立顶端-基底极性。小鼠中致密化的开始或其特征是依次建立以CDH1为marker的黏附链接,以ZO1为marker的紧密连接。本文研究了人胚顶端-基底极性的建立。人胚免疫染色结果显示CDH1在桑葚胚期基底外侧膜表达,随后顶端招募ZO1。这一结论与其他哺乳动物类似,即也具有顶端-基底极性及相关的分子事件。
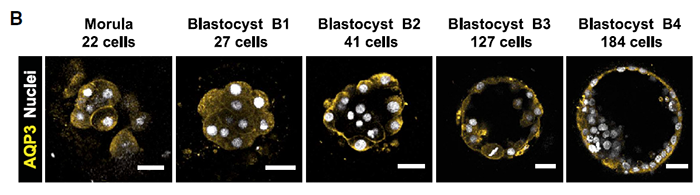
在细胞极化和致密化后,另一重要事件是囊胚腔的形成。该事件由morula/early blastocyst 表达的水通道蛋白介导。AQP3是人着床前胚胎主要表达的水通道蛋白,是少数最初在所有细胞中表达后来仅限于TE表达的基因之一。免疫染色显示它在morula期定位于细胞膜,B2期被限制在顶端。故B2囊胚ICM中AQP3的确实可能表明一个与ICM相关的程序开始启动,与拟时结果相对应。
整合这些结果可以将致密化和空腔化与拟时分析上未定义的数据相对应,故CDH1/ZO1/AQP3 同样可以作为人胚分子事件的markers。
IFI16 and GATA4 highlight progression of EPI and PrE specification
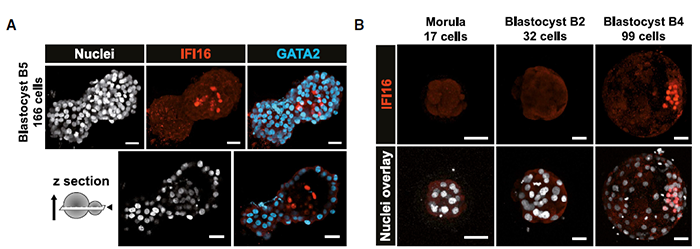
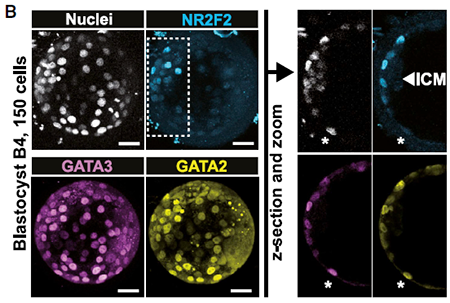
目前,用于研究人EPI/PrE 的markers数量有限,尤其是缺少可以追踪EPI/PrE细胞命运变化的markers。在此,本文从B5 孵化囊胚中鉴定已发育为EPI的细胞的markers。在转录因子层面,重点研究了IFI16在B5胚胎中的蛋白表达情况。结果显示,IFI16仅在ICM中有阳性荧光,GATA2仅在TE中有阳性荧光。B2前胚胎未检测到IFI16,B4后ICM 细胞明确检测到IFI16,这些结果与之前的研究类似,即IFI16和EPI 间存在联系。
为了进一步探索IFI16在ICM 中的作用,此处进行了NANOG/GATA4共染(二者在扩张囊胚中互斥)。在B4-B5胚胎中,IFI16可以与NANOG阳性细胞(EPI)和GATA4阳性细胞(PrE)共定位。为了确定IFI16是否为某个确切谱系的marker,作者采用体外培养方案模拟胚胎着床过程。B3或B4胚胎体外培养72h后,可以等同为E8。作者观察到NANOG阳性细胞仍表达IFI16,而GATA4阳性细胞中IFI16弱表达或已不表达。免疫荧光定量结果表明,着床前ICM 细胞广泛表达IFI16,着床后高表达IFI16的细胞则GATA4不亮。
体外培养
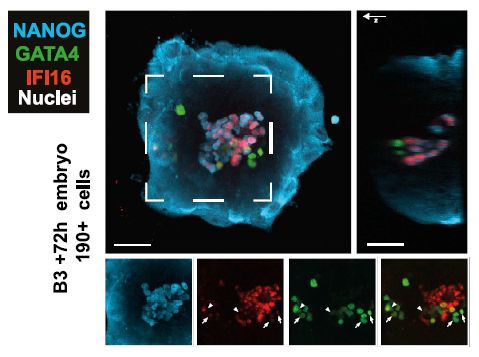
IFI16和GATA4荧光定量
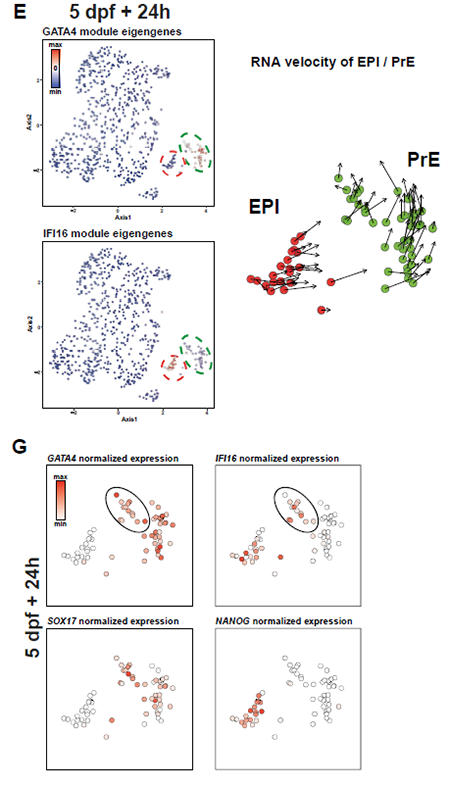
IFI16仅在着床后EPI中表达,故IFI16不表达可能意味着细胞向PrE走。随之可以提出这样一个假设:PrE在人胚中的分化可能比EPI更晚:
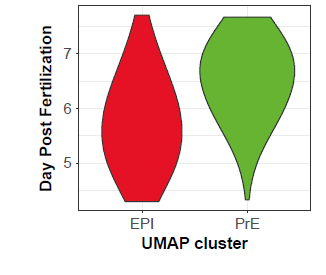
PrE在人胚中的分化可能比EPI更晚
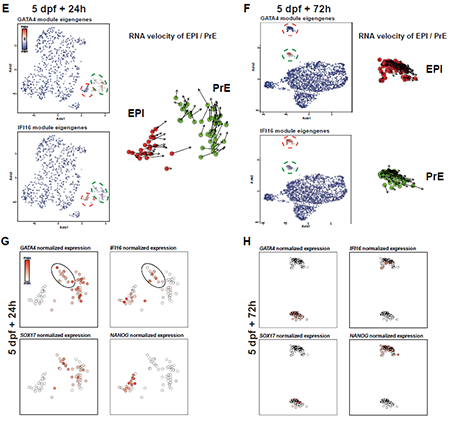
困难在于,人胚中难以像小鼠一样可以分离出有明晰分子特征、为EPI和PrE祖细胞的ICM,这意味着人EPI 和ICM 可能高度相似,亦或PrE与EPI发育显著不同。为更好理解PrE细胞命运,此处分析了人培养120h后转移到IVC 培养基中继续培养至216h(14days)的scRNA-seq数据集[1]。本文分析重点在day5 + 24h & day5 + 72h的培养时期。UMAP显示,EPI和PrE细胞在day5 + 24h 的cluster更近;IFI16和GATA4在day5 + 24h 胚胎中共表达,在day5 + 72h中则并非如此。结合本文与其他着床后胚胎数据的RNA速率分析显示,在晚期囊胚中一些EPI 细胞的基因表达向PrE转变,该发现支持了上文的假设,即PrE谱系开始在B4期开始特化,且PrE可能由转录谱系上接近EPI 的细胞分化而来。在B3阶段还需要进一步分析,以确定最终成为PrE的细胞的分子状态。
为了进一步验证之前的结果,此处探索了OTX2这个marker。OTX2在鼠上是个EPI相关谱系marker,但已被证实和人PrE有关。在人着床前和着床后胚胎中发现OTX2 仅与GATA4阳性细胞共定位,而在NANOG阳性细胞中不表达。此外,OTX2 在更靠近NANOG阳性细胞的GATA4阳性细胞中表达。OTX2是否代表了PrE更进一步的发育状态或PrE亚群仍有待探索。
综上,转录分析结合免疫荧光发现,人EPI/PrE特化发生于B4(晚期)囊胚中,这与小鼠在早期囊胚即发生特化不同。
NR2F2 marks TE maturation at the polar side of human embryos
接下来研究了TE分支中的细胞成熟事件。转录因子 NR2F2在TE分支中后部表达,与孵化和扩张囊胚相关。B5囊胚免疫荧光显示,NR2F2核定位且仅在与表达NANOG 的EPI并列的极化TE细胞中表达:
NR2F2核定位且仅在与表达NANOG 的EPI并列的极化TE细胞中表达
在B4囊胚中,GATA2/3在TE中均有表达,而NR2F2仅在极化TE亚群中表达:
NR2F2仅在极化TE亚群中表达
拟时分析表明,表达NR2F2的TE是最成熟的TE,因为它们处于轨迹末端。不过,免疫荧光表明NR2F2在B4胚胎也有表达,而B4 期TE位于拟时轨迹的中部,这表明TE的成熟开始于EPI-TE 互作的极化一侧。
为进一步明晰NR2F2+细胞的起始,作者将NR2F2与EPI marker IFI16和PrE marker GATA4共染。结果显示NR2F2与其他俩基因同期表达(B5囊胚):
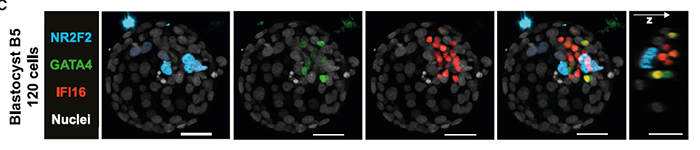 NR2F2与其他俩基因同期表达
NR2F2与其他俩基因同期表达
对B3/B4 + 72h 体外培养胚胎的NR2F2 染色证实NR2F2 在所有TE中均表达:
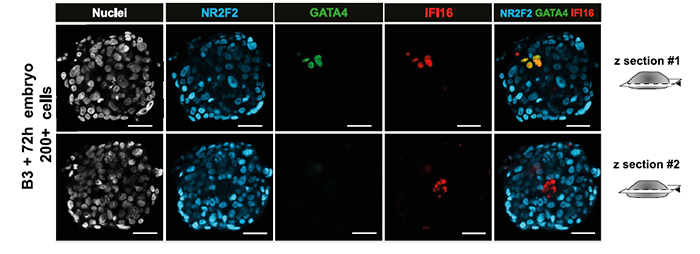
故而作者认为TE的成熟时通过与EPI 的接触而开始的,随后在着床时逐渐成熟。
TE在极化侧开始成熟这一现象与大多数人囊胚在极化侧附植于子宫内膜,随后TE发育扩散到内壁细胞上的结果一致。随后,将TE分为NR2F2+ 和NR2F2- 组来研究极化TE的pathway。这些通路与NR2F2+ 极性TE细胞的受体如GM-CSFR 和子宫内膜的配体如GM-GSF 有关。通过fGSEA 分析最富集的信号通路确定了最可能驱动EPI到TE分子对话的候选通路,如:TGF-β、IGF1、BMP2和FGF4;TE到EPI分子对话的候选通路如:PDGF、IL-6、WNT:
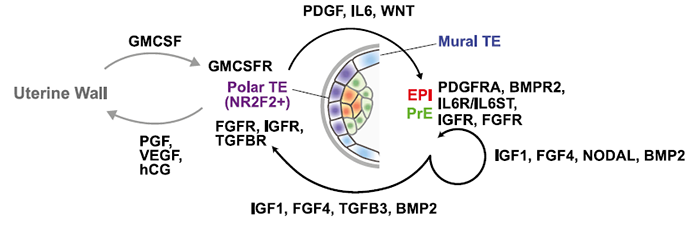
这表明,尽管FGF4无法参与调控PrE谱系特化,但在着床前胚胎发育中仍有作用;近期由研究表明BMP信号通路可能抑制成腔,不过在第一次谱系分离中的功能仍有待解析;猪上的研究结果表明IL-6敲除或抑制JAK信号通路可以抑制着床前胚胎发育,故有此假设:人和猪中,在没有LIF的情况下,JAK/STAT信号通路可能是由IL-6触发的。人中极性TE-EPI的互作很容易让人联想到小鼠囊胚中ICM-极性TE的互作,因小鼠EPI对TE的成熟是必要的。不过人亦可能存在物种特异事件,如小鼠TE成熟因子KLF6在人TE中就无关紧要。
综上,B4扩张囊胚中,NR2F2 marker 成熟TE,并会扩展到所有TE细胞。NR2F2+细胞的鉴定会产生出很多关于极化TE-EPI-子宫内膜彼此两两互作的假设。
DISCUSSION
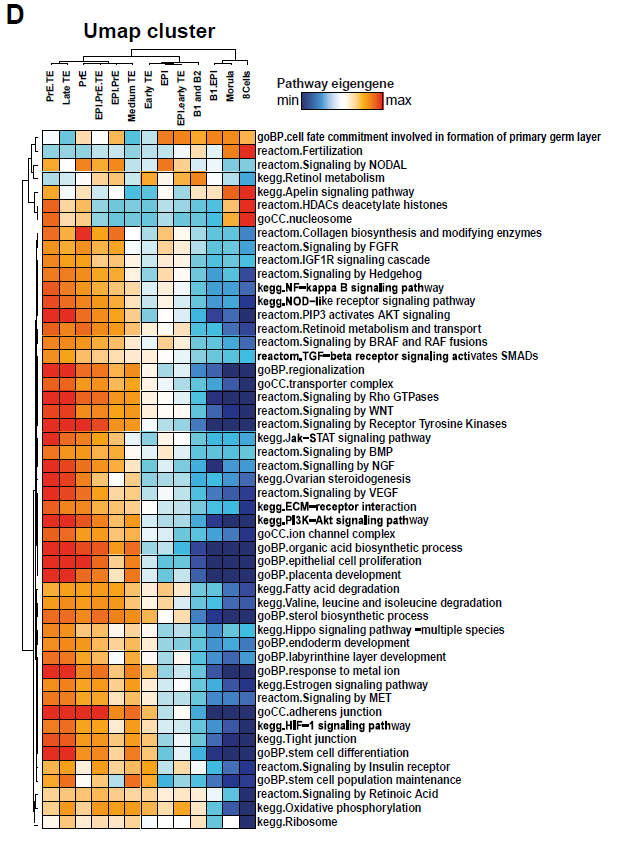
本文利用scRNA-seq进行了谱系重建,生成了人鼠着床前胚胎连续的转录图谱。小鼠的拟时分析证实了已有的功能实验,如在晚期16细胞morula Cdx2表达后,早期32 细胞morula的转录水平就出现不同了。在实验层面,小鼠TE在32细胞期出现,而ICM 可能已产生特化的苗头,但未在此时产生。人拟时分析的结果表明B2-B3期的TE转录水平明显不同。本文中的胚胎-胚胎分析策略显示,在细胞完全分离到两种谱系的任一种之前,人桑葚胚已经表现出转录异质性。拟时分析和基因相关模块结合,某些基因模块与拟时分支相对应。免疫荧光发现IFI16在多数ICM中表达而在PrE中消退。此外,TE的成熟起源于极化侧,与临近的EPI发生分子对话。总结本文的研究成果如下图:
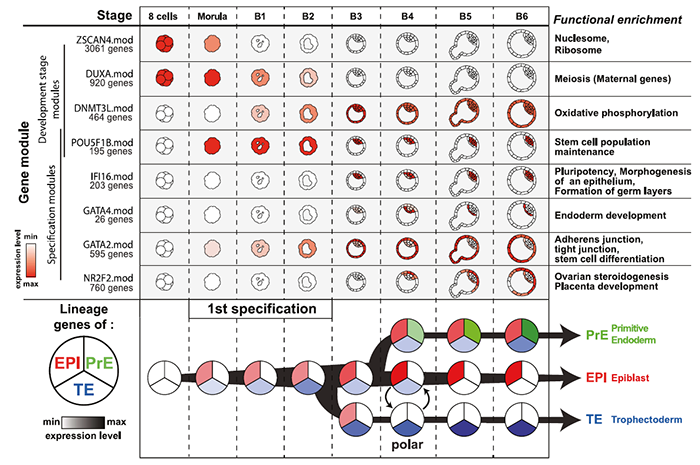
本文解决了人胚体外培养异质性的问题,将dpf4、5、6的注释去冗余。在dpf5时,如果以天数区分,就会将B1-B4囊胚的信息平均化,因为TE/EPI/PrE均在此阶段出现,将它们归到一个stage就会产生数据噪音。本文结合了延时成像和scRNA-seq解决了这一问题。
在哺乳动物着床前胚胎发育过程中,俩事件特明显:致密化和成腔。致密化在人鼠中似乎与epithelialization有关,有研究表明,致密化与Hippo通路一同在morula和B1期触发了TE命运启动,其特点时GATA3在外层细胞表达。本研究发现,morula期细胞异质性增强但未到细胞命运决定阶段。与小鼠相比,人TE/ICM的转录特征出现较迟,这表明,除了致密化之外,可能需要其他途径调节谱系分离,有可能是细胞分裂或其他因素。人morula在10细胞期开始致密化,在20细胞期开始成腔到达B1期,随后迅速发育为包含有40个细胞的B2期囊胚。这表明,在细胞启动/完成ICM/TE 相关的转录程序之前,需要经过致密化后的两轮细胞分裂;这一阶段与小鼠相似但小鼠略微更早:小鼠在8细胞期开始致密化,32细胞期出现不同细胞表达。至于成腔,本文发现AQP3在B2期TE表达,不过AQP3表达是否依赖于TE命运决定因子或TE命运决定因子依赖AQP3表达有待证实。
之前的研究无论采取何种方法,人EPI/PrE谱系规范都没解决了、本研究表明,在ICM内,EPI的谱系最先产生,小鼠中亦如是,EPI分泌Fgf4才能使得PrE谱系产生。关于PrE谱系,本研究发现,在长期培养的胚胎中PrE特征更明显;在IVC培养基中的E6胚胎似乎比在IVF中的E6胚胎有更多的PrE细胞,猜测是IVC支持长期培养所致;另一种可能是IVC培养基有利于人胚的快速发育。
作者认为人EPI/PrE特化有两个主要假设:
(1)早期ICM细胞在转录上比PrE或TE更接近EPI,导致ICM细胞与EPI细胞混合; (2)PrE从EPI分化出来。
要解决这些假设,还需要更多的实验,本研究提供了一个框架:确定了与特化markers表达相关的形态,并提供了有关EPI/PrE特化的新markers,如IFI16和GATA4。特别是IFI16,体现了EPI和PrE在 围着床期过程中分子状态间的过渡。IFI16的表达表明,IFNg信号可能对EPI的特化很重要。此外,IFI16已被证明可诱导免疫细胞中病毒启动子的表观沉默。故一个假设是IFI16在morula期可能会抑制转座元件的喷发式表达。沉默转座元件可能是EPI/PrE特化的必要条件。
从转录组上看,TE在从B2向B3阶段过渡时产生了独特的表达谱,细胞多能性基因逐渐失活,这与TE细胞的可塑性丧失相对应。本研究发现TE成熟可能与EPI-TE分子对话有关;在其余壁层TE成熟前,极化TE与相邻EPI已启动着床。但在小鼠中,EPI分泌的Fgf4和nodal促使壁层TE和极化TE的发育,着床由壁层TE和极化TE共同主导,这可能就是物种 特异性了。是何促进TE成熟即NR2F2是否在人鼠保守值得探究。
已有研究表明,TE的形态质量对IVF的成功很有影响。可以关注NR2F2+细胞的特定marker,可以评估试管婴儿的着床潜力。
本研究还提供了重构胚的关键事件。与处于不同多能性的干细胞比较发现,在目前已建系的细胞中,naive ESC 最接近着床前EPI(5.8dpf);常用的primed ESC接近着床后EPI(10dpf);此外,naive ESC可以转变为hTSC,这可能与晚期囊胚细胞特化事件类似;此外,hTSC类似着床后day 8 滋养层。
本研究阐明了着床前胚胎发育的分子事件与信号通路发生的具体时间,微调这些通路可以改良培养基配方和IVF程序。
Limitations of study
这个文章还单独把不足之处写出来了。
即谱系追踪尚需进行,一般用 LINNAEUS[2]、MEMOIR[3]、scGESTALT[4]这几种方法研究,不过在人上搞恐怕是不太行。
本文作者:登峰,单细胞天地
Links
数据链接:https://www.ebi.ac.uk/ena/browser/view/PRJEB30442
对齐流程:https://gitlab.univ-nantes.fr/E114424Z/SingleCell_Align
标准化流程:https://gitlab.univ-nantes.fr/E114424Z/singlecellnormalize
WGCNA:https://gitlab.univ-nantes.fr/E114424Z/WGCNA
拟时和聚类:https://gitlab.univ-nantes.fr/E114424Z/monocle2_workflow
开源网页:https://gitlab.univ-nantes.fr/E114424Z/ptuihost
文中链接
scRNA-seq数据集: https://www.nature.com/articles/s41586-019-1500-0
[2]LINNAEUS: https://links.jianshu.com/go?to=https%3A%2F%2Fwww.ncbi.nlm.nih.gov%2Fpmc%2Farticles%2FPMC5942543%2F
[3]MEMOIR: https://links.jianshu.com/go?to=https%3A%2F%2Fwww.ncbi.nlm.nih.gov%2Fpmc%2Farticles%2Fpmid%2F27869821%2F
[4]scGESTALT: https://links.jianshu.com/go?to=https%3A%2F%2Fwww.ncbi.nlm.nih.gov%2Fpmc%2Farticles%2FPMC5938111%2F













