
导 读
胃癌是世界范围内发病率和死亡率最高的恶性肿瘤之一,特别是在中国、日本和韩国等东亚国家。胃肿瘤的发生是一个多阶段、缓慢进展和多因素的病理过程。已证实的胃癌高危因素包括幽门螺杆菌感染、过量摄入盐和硝酸盐、肥胖和A型血。此外,基因突变、表观遗传学改变和分子信号通路的异常也参与了胃癌的发生和转移。由于早期胃癌缺乏特异性症状,大多数胃癌患者被诊断为中晚期,预后较差。因此,迫切需要明确胃癌的基因表达模式和生物标志物,以促进胃癌的研究,提高患者的生存率。
环状rna(CircRNA)是一种特殊的非编码rna分子,近年来成为非编码rna领域的研究热点。与传统的线性RNA不同,CircRNA具有没有5‘帽或3’聚A尾巴的闭环结构。CircRNAs的表达比线性RNAs更稳定,分子也不那么容易降解。随着高通量测序技术和生物信息学分析的发展,越来越多的CircRNA被发现调控细胞的增殖、迁移、侵袭、凋亡和分化。已发现绝大多数CircRNA通过充当microRNA(MiRNA)海绵或与蛋白质结合来发挥其生物学功能。一些研究还表明,含有内部核糖体进入位点(Irss)或广泛的甲基修饰位点的CircRNA有可能通过编码蛋白质来影响生理行为。例如,circβ-catenin通过编码β-catenin-370aa激活Wnt通路,从而促进肝癌细胞的生长。SHPRH-146aa由CIRC-SHPRH编码,能保护全长SHPRH不被泛素蛋白酶体降解,抑制胶质瘤的发生。最近,CircRNAs作为miRNA和蛋白质的海绵在GC中的作用已得到证实。然而,CircRNAs是否通过编码蛋白调控胃癌的发生和发展尚不清楚。
在本研究中,作者通过分析来自不同数据库的RNA序列数据,鉴定了一个来自MAPK1基因的CircRNA,命名为CircMAPK1。CircMAPK1在胃癌组织和细胞中的表达降低,与胃癌患者预后良好有关。功能研究表明,CircMAPK1在体内外均能抑制胃癌细胞的生长。随后的研究表明,CircMAPK1编码一个新的109个氨基酸(AA)的MAPK1亚型。与MAPK1相反,MAPK1-109aa通过与MEK1竞争降低MAPK1磷酸化,抑制MAPK1及其下游因子的激活,从而抑制胃癌细胞的增殖和侵袭。作者的结果表明MAPK1途径的抑制剂MAPK1-109aa是一种有效的胃癌诊断工具和治疗靶点。
论文ID
题目:A novel protein encoded by circMAPK1 inhibits progression of gastric cancer by suppressing activation of MAPK signaling
译名:CircMAPK1编码的新蛋白通过抑制MAPK信号通路抑制胃癌进展
期刊:Molecular Cancer
IF:15.302
发表时间:2021.4.9
通讯作者单位: 南京医科大学第一附属医院
DOI号:https://doi.org/10.1186/s12943-021-01358-y
主要内容
由于MAPK信号通路在肿瘤的发生和发展中起着重要的病理作用,作者首先根据在线数据库CircBase中的CircRNA测序数据分析了来自MAPK通路相关基因的CircRNA。然后统计了6个非肿瘤细胞系和6个癌细胞系中与MAPK通路相关的CircRNA的数量,发现这些细胞系中的大多数都能表达数百个与MAPK通路相关的CircRNA。这暗示了MAPK途径衍生的CircRNA在人类疾病中的重要性。
然后,由于MAPK1在MAPK途径中的关键作用,作者将重点放在了MAPK1产生的15个CircRNA上。在来源于MAPK1的CircRNA中,CIRC-0006203、CIRC-0004872和CIRC-0008870在三个以上的独立测序数据集中被广泛检测到。应用实时定量聚合酶链反应(qrt-pcr)检测了40例胃癌及其配对癌旁组织中这三种CircRNAs的表达水平。结果表明,circ-0004872的表达变化最为显著。此外,在GSE121445和GSE100170数据库中也证实了circMAPK1在GC中的下调。这些数据提示了cic-0004872的潜在抑制作用,从而促使我们进一步研究其在胃癌恶性中的作用。
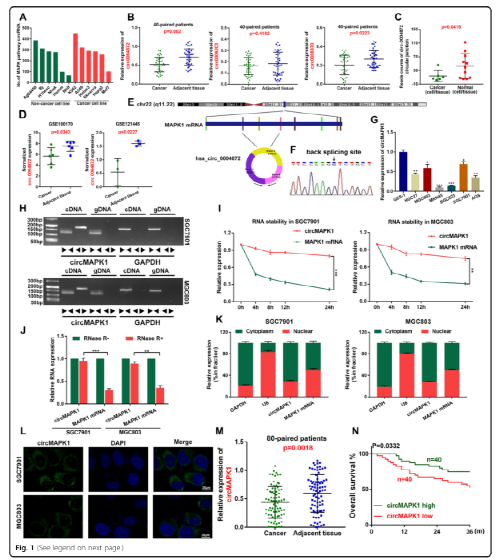
图一:GC中CircMAPK1的鉴定及特性
为了研究CircMAPK1在胃癌中的生物学功能,设计了针对CircMAPK1后剪接区的小干扰RNA(SiRNAs)。由于CircMAPK1在SGC7901和MGC803细胞中表达较高,作者将siRNAs导入SGC7901和MGC803细胞中。随后的CCK8、克隆形成和EdU实验表明,沉默circMAPK1可显著增强GC细胞的增殖能力。流式细胞仪检测细胞周期进程。作者发现CircMAPK1的减少增加了处于S期的GC细胞的数量,表明CircMAPK1抑制了肿瘤细胞的细胞周期进程。进一步的Transwell和迁移显示SicircMAPK1促进GC细胞迁移。综上所述,这些结果表明CircMAPK1在胃癌细胞的增殖和迁移中起着关键作用。
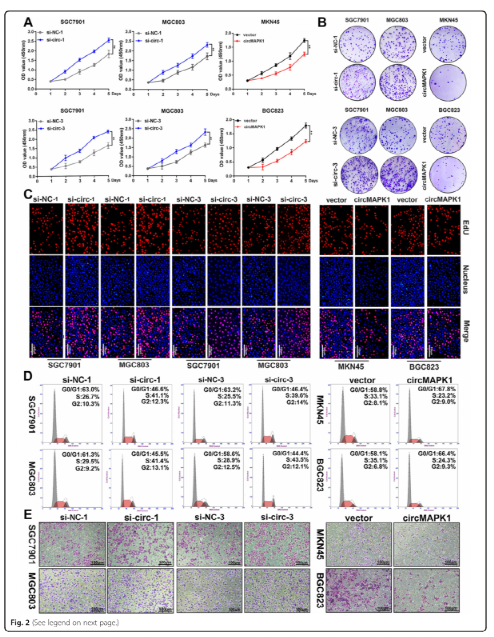
图二:CircMAPK1体外抑制功能的研究
为了进一步证实体外研究结果,作者随后验证了CircMAPK1在影响体内致瘤性方面的生物学作用。构建了稳定敲除CircMAPK1的SGC7901-sh和MGC803-sh细胞系。将这两种稳定的细胞系接种于裸鼠皮下,每周观察皮下肿瘤生长情况。CircMAPK1的沉默极大地促进了肿瘤的生长。相反,过表达CircMAPK1的MKN45和BGC823细胞系显著抑制皮下肿瘤的生长。接下来,作者通过对Ki67(增殖细胞的标志物)染色来监测异种移植瘤的增殖情况。CircMAPK1稳定敲除的肿瘤组织Ki67染色较强,而CircMAPK1过表达的肿瘤组织Ki67染色较弱。总之CircMAPK1抑制体内胃癌发生和转移。
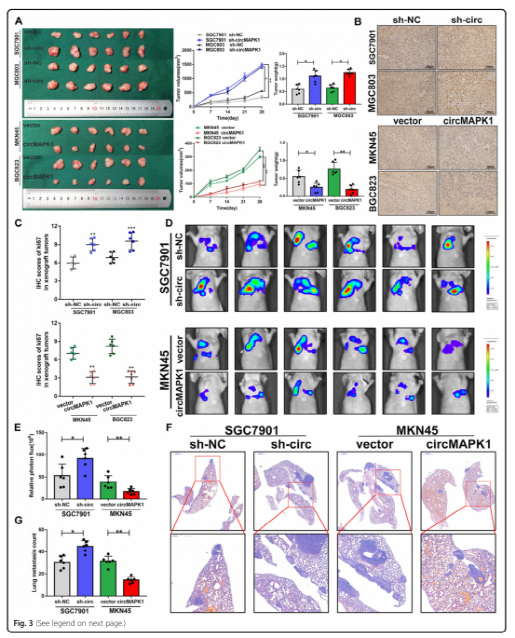
图三:CircMAPK1在体内的抑制功能
总 结
综上所述,作者在胃癌中发现了一种新的从MAPK1中下调的CircRNA。由CircMAPK1编码的MAPK1-109aa通过与MAPK1竞争结合上游激酶MEK1,抑制MAPK1的磷酸化和下游致癌因子发挥抗癌作用。作者的研究结果提示,CircMAPK1可能成为胃癌的治疗靶点,同时也为MAPK通路激活引起的疾病提供了新的治疗思路。
原文链接
https://doi.org/10.1186/s12943-021-01358-y
参考文献
1.Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424.













