过去的十年中,越来越多的研究表明肠道菌群和炎症性肠病(IBD)具有相关性。由于缺乏肠道微生物群的纵向研究和IBD诊断前的数据,目前尚不清楚肠道微生物组的变化是炎症性肠病的原因还是结果。今天就为大家介绍这篇2021年1月份发表在Gastroenterology上的肠道微生物群文章。
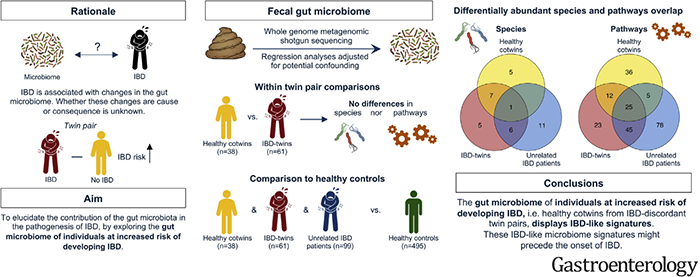
来自荷兰的研究团队开展了一项关于IBD双胞胎的肠道微生物群研究,收集健康、IBD双胞胎、健康人群和不相关IBD患者(年龄、性别和BMI相匹配)的粪便样本进行宏基因组测序,分析发现健康双胞胎与IBD双胞胎、不相关IBD患者具有相同的肠道微生物特征。其中健康双胞胎、IBD双胞胎和不相关IBD患者肠道中存在重叠的物种和通路。其中共享的通路包括潜在炎症相关通路,如丙酸降解和L-精氨酸降解途径的增加,表明IBD双胞胎和健康双胞胎肠道微生物群有类似的IBD特征,这些类似的IBD微生物群特征可能先于IBD的发生。研究人员表示肠道微生物在IBD发病过程中扮演重要角色。
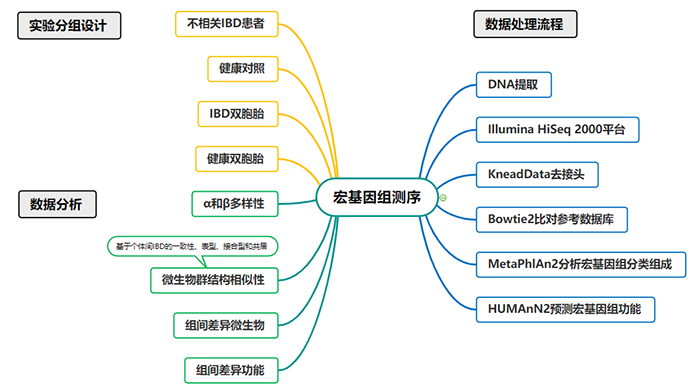
(1)分组设计:本横断面研究纳入了2组受试者:①99名大于16岁的IBD双胞胎和健康双胞胎(来自51对),受试者在乌得勒支大学医学中心(UMC)进行纵向随访(每隔6个月进行评估),期间收集血液、尿液、粪便、口咽拭子和结直肠活检样本。②年龄、性别和BMI与双胞胎患者相匹配的健康对照(495名)和不相关IBD患者(99名)。(2)样本采集:对于双胞胎队列,粪便样本采集后现在室温下保存,随后在31小时内冻存到-80℃冰箱;在健康人群和IBD患者队列中,粪便样本采集后按先冻存在-20℃冰箱(受试者家中),随后通过干冰运输到研究设施并冻存到-80℃冰箱。(3)DNA提取和测序:微生物通过QIAamp Fast DNA Stool Mini Kit分离提取,随后使用Illumina HiSeq 2000平台进行宏基因组测序。(4)质量控制:原始数据通过KneadData去除接头并进行修剪(PHRED质量>30),随后使用Bowtie2将比对到人类参考基因组(GRCh37/hg19)的序列去除,使用FastQC检测数据质量。通过MetaPhlAn2对序列进行宏基因组分类组成分析,使用HUMAnN2预测宏基因组功能。(5)数据分析过程:首先比较健康双胞胎和IBD双胎的肠道微生物群,随后比较健康双胞胎、IBD双胞胎、IBD患者和健康对照的肠道微生物群。分析以下几个方面:①α和β多样性;②基于个体间IBD的一致性、表型、接合型和共居分析肠道微生物群的相似性;③评估不同队列中微生物物种和功能的相对丰度差异和重叠。(6)统计分析:所有分析由R语言完成(代码:https://github.com/WeersmaLabIBD/Microbiome/blob/master/IBD_Twins_Microbiome_Utrecht_Groningen.md)共招募99名双胞胎(51对)和495名年龄、性别、BMI相匹配的健康对照,以及99名不相关IBD患者入组。99名双胞胎中有53名属于同卵双胞胎,46名属于异卵双胞胎。51对双胞胎中IBD一致的有12对,不一致(只有一方患有IBD)的有39对。有阑尾切除术和抗生素或PPI使用史的双胞胎和不相关IBD患者比健康对照组更常见。更多的IBD双胞胎被诊断为CD (54.1% vs 28.3%)。2.2健康双胞胎和IBD双胞胎肠道微生物群多样性相似,与健康对照不同在微生物群分类和功能水平上,健康双胞胎和IBD双胞胎微生物群α多样性没有显著差异。与健康对照相比,健康双胞胎和IBD双胞胎的微生物丰富度(Richness)明显更高。同时,健康双胞胎和IBD双胞胎微生物群分类和功能的β多样性(PERMANOVA of Bray-Curtis,如图1)也没有显著差异,但均与健康对照不同。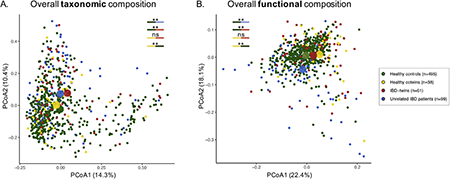
图1 健康双胞胎和IBD双胞胎的肠道微生物组成(β-多样性)没有明显差异,但都与健康对照组不同。
2.3 IBD一致性、表型、接合性和共居与肠道微生物组成之间的关系通过比较个体间的Bray-Curtis距离的差异来评估取样时IBD一致性、表型、接合性和共同居住与个体间肠道微生物组成异质性的关系。发现IBD不一致双胞胎和IBD一致双胞胎在分类和功能水平上没有差异, 与观察到的健康双胞胎和IBD双胞胎肠道微生物多样性的相似性一致(图2A)。与不相关健康对照组相比,健康双胞胎到UC再到CD双胞胎的肠道微生物差异逐渐增加,说明肠道微生物的组成在IBD中的异质性变化(图2B)。在取样过程中,同卵双胞胎、异卵双胞胎或共同居住的双胞胎的肠道微生物群与随机健康对照组没有更相似(图2C、D)。
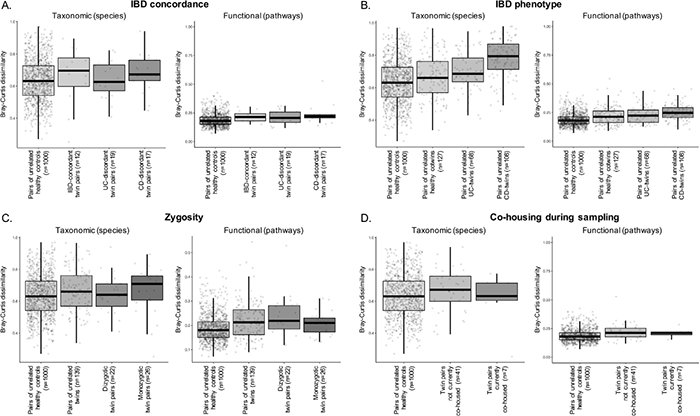
图2 随机健康个体肠道微生物组成与IBD一致性、接合性或共同居住双胞胎的肠道微生物组更相似。
2.4 健康双胞胎、IBD双胞胎和不相关IBD患者与健康对照组相比在物种和通路的相对丰度上有所不同为了鉴定健康双胞胎肠道微生物特征是否与IBD双胞胎、不相关IBD患者或健康对照组微生物组相似性,对IBD亚型(CD,UC,和无IBD)进行多变量线性回归分析(年龄、性别、BMI、抗生素和PPI使用、测序深度)。在双胞胎队列分析中,额外调整了接合性和患病部位,发现IBD双胞胎和健康双胞胎之间没有显著差异的物种和通路。然而与健康对照相比,IBD双胞胎肠道微生物群有19种差异物种和105种差异通路,不相关IBD患者有18种差异物种和153种差异通路。健康双胞胎和健康对照组的肠道微生物群中也有13种微生物和78种通路的相对丰度显著差异(图3)。2.5 与健康对照组相比,健康双胞胎与IBD双胞胎和不相关的IBD患者具有相同的微生物类群和通路与健康对照组相比,IBD双胞胎中有19个物种和105个通路存在差异,其中8个物种和37个通路在健康双胞胎中也存在差异。此外, 不相关IBD患者和健康对照组之间的18个差异物种和153个差异通路中,有1个物种和30个通路在健康对照组和健康双胞胎之间也存在差异(图3)。
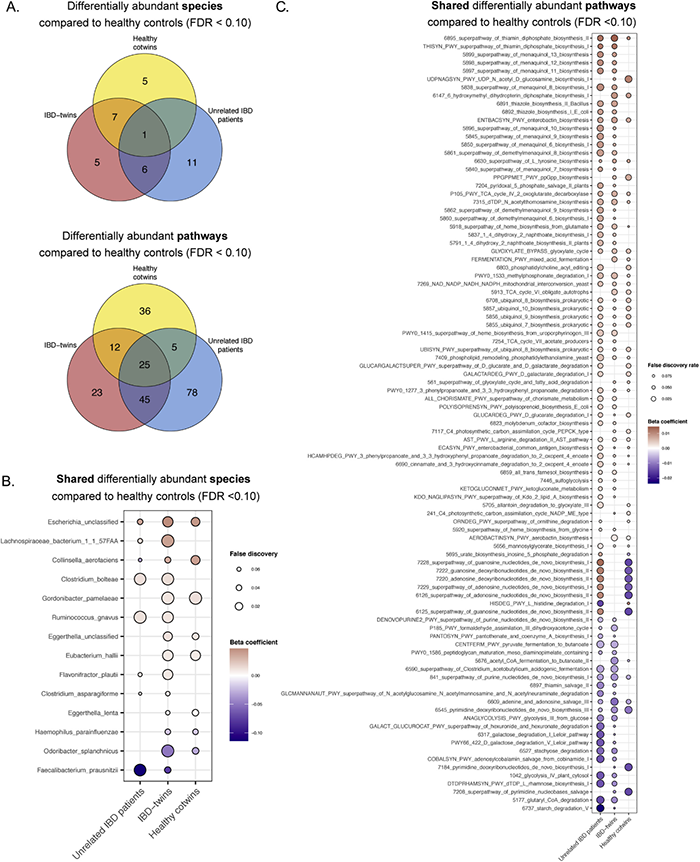
图3 健康双胞胎、IBD双胞胎和不相关的IBD患者的肠道微生物群种物种和通路相对丰度与健康对照组具有显著差异。
与健康对照相比,健康双胞胎、IBD双胞胎和不相关IBD患者中潜在的病原微生物,如Escherichiaunclassified、Gordonibacterpamelaeae和Eggerthellaunclassified相对丰度增加。IBD双胞胎和不相关IBD患者的Faecalibacteriumprausnitzii较健康对照相对丰度增加(图4)。
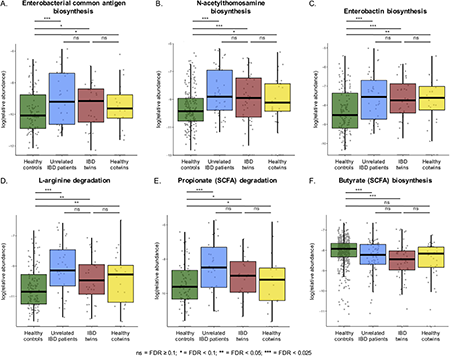
图4 IBD相关物种的相对丰度
与健康对照相比,健康IBD、IBD双胞胎和无关IBD患者中科特异性表面肠杆菌共抗原(Escherichia)、铁载体(肠杆菌素和产气菌素)的生物合成途径和编码精氨酸降解基因的相对丰度增加。与健康对照组相比,健康双胞胎和IBD双胞胎中一种短链脂肪酸丙酸的降解途径增加。随着F. prausnitzii丰度降低,IBD双胞胎和不相关IBD患者的丁酸盐合成途径相对丰度较健康对照组降低。与健康对照组相比,健康双胞胎、IBD不一致双胞胎的肠道微生物群中潜在致病性物种和促炎症途径增加(图5)。
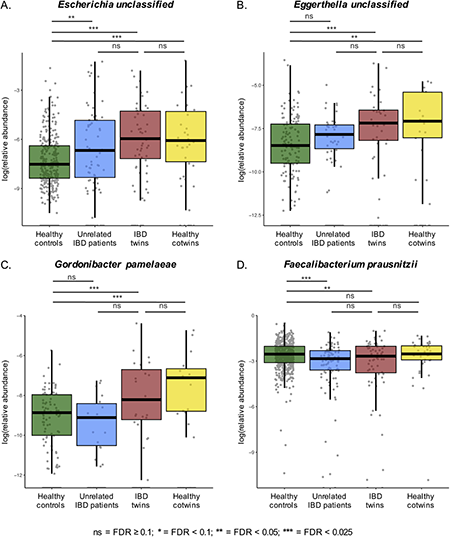
图5 IBD相关通路的相对丰度
这项横断面研究通过宏基因测序方法分析了IBD双胞胎的肠道微生物组,发现健康双胞胎和IBD双胞胎之间的α和β多样性、物种和通路的相对丰度没有显著差异。与年龄、性别和BMI匹配的健康对照组相比,健康双胞胎与IBD双胞胎,以及不相关IBD患者在微生物群物种和通路上有很大的重叠,存在与IBD相关的物种和潜在炎症相关通路。
这表明IBD的诊断可能是在微生物组成改变之前,或者IBD的风险增加与微生物组成改变有关,或者两者兼而有之。与之前基于16S测序的小样本量IBD双胞胎微生物组研究结果相反,本研究中IBD双胞胎和健康双胞胎之间的微生物类群和通路的相对丰度没有统计学差异。为了进一步揭示IBD双胞胎肠道微生物组的形成过程,将不相关IBD患者纳入研究。不相关IBD患者和IBD双胞胎的微生物类群和通路只有微小的差异。健康双胞胎不仅与IBD双胞胎在微生物种类和途径上有重叠,还与不相关IBD患者也有重叠。这说明共享的环境因素和遗传背景并不是IBD双胞胎和健康双胞胎之间微生物群类群重叠的唯一解释。健康双胞胎的一个IBD特征是一种未分类Escherichia相对丰度的增加。之前的报道表明这种未分类Escherichia与UC和CD具有相关性,可能是IBD的关键致病因素。此外,科特异性肠菌共抗原的生物合成途径在健康双胞胎、IBD双胞胎和不相关IBD患者中增加,这种途径由Enterobacteriaceae科所有菌属所共享。与健康对照组相比,健康双胞胎、IBD双胞胎和不相关IBD患者中一种已知毒性因子Fe3þ铁载体的相对丰度增加。此外,健康双胞胎、IBD双胞胎和不相关IBD患者中编码精氨酸降解以及编码丙酸(一种短链脂肪酸SCFAs)降解基因的相对丰度增加。精氨酸是多胺(有助于肠道的完整性和减少促炎细胞因子的表达),而SCFAs是肠上皮细胞的重要能量来源,补充SCFAs可以减轻结肠炎症。总之,研究发现来自IBD不一致双胞胎的健康双胞胎的肠道微生物组在分类和功能水平上都表现出IBD相关特征。这些个体的肠道微生物群与他们患IBD的双胞胎和不相关的IBD患者的肠道微生物群相似,而与健康对照组不同。这些类IBD微生物群特征反映了共同的遗传背景和环境,并可能先于IBD的发展。健康双胞胎的类IBD微生物群特征可能先于IBD的发展,并反映了这些个体间共有的基因组成和环境因素的影响,但并不一定导致IBD的发展。因此,对IBD发病前的高危人群进行多时间点采样的纵向研究是十分必要的。
点评:这项研究是目前IBD和微生物组领域最大的双胞胎队列研究,采用大样本量+宏基因组测序方法精确揭示了IBD相关肠道微生物群。作者仔细比较IBD一致和不一致双胞胎、健康人群以及不相关IBD患者种重叠微生物组的多个方面,并通过多变量线性模型对混杂因素进行了调整,思路严谨值得借鉴。但是本研究中的多个队列因为采样、样本保存、DNA提取方法有所差异,可能会产生 批次效应。虽然针对双胞胎IBD患者的16S测序研究已经多有报道,但是这篇文章仍可以发表在17+ Gastroenterology上,凭借的新颖的分组设计,通过分析IBD一致/不一致/共居双胞胎菌群排除环境和饮食的影响,加入不相关IBD患者进一步增加了差异菌群鉴定的准确性。大样本量的高通量测序结果更有说服力,而通过宏基因组测序技术可以深入探讨IBD相关差异菌种和功能。这篇文章还缺少IBD发生发展过程中微生物群动态变化的纵向研究,这也将是今后几年微生物组领域的重要研究方向。
参考文献:
[1] Brand EC,Klaassen MAY, Gacesa R, Vila AV, Ghosh H, de Zoete MR, Boomsma DI, Hoentjen F,Horjus Talabur Horje CS, van de Meeberg PC and others. Healthy cotwins sharegut microbiome signatures with their inflammatory bowel disease twins andunrelated patients. Gastroenterology 2021.




















