相信每一位曾经上过生物化学课程的同学,即使将所有繁琐的代谢途径忘得一干二净,也会毕生铭记那张密密麻麻令人窒息的代谢网络图。
代谢的复杂性也让很多代谢研究呈现出放飞自我的状态。做自噬的,做免疫的,做神经,做死亡的,最终都可能跟你说,我们是做代谢的。其实他们很多只能算跟代谢有交叉,并不算纯正的代谢研究。
去年年末,武汉大学生命科学学院宋保亮教授课题组在Nature上发表了一篇标题为Feeding induces cholesterol biosynthesis via the mTORC1-USP20-HMGCR axis的文章,阐明了进食诱导胆固醇合成的机制。
该论文几乎涵盖了目前的代谢研究能够涉及的所有方面,且都做到了顶级,堪称顶级代谢研究的典范。

之前听过一位做代谢的大牛总结过构成顶级代谢研究的几大要素:
(1)代谢领域的重大问题;
(2)全面而深入的机制解析;
(3)重要技术和方法的运用;
(4)有助于相关药物的开发。
其实,这几大要素对于很多其它领域的顶级研究也同样适用。笔者姑且就宋宝亮教授课题组的Nature文章做一简要解读,看看这篇文章如何将以上的4大要素体现得淋漓尽致。
代谢领域的重大问题
胆固醇是机体内重要的代谢产物,与众多的生理病理过程相关。机体既可以从食物中摄取胆固醇,也可以从头合成胆固醇。然而,胆固醇合成的步骤繁多,需要消耗机体大量的营养和能量。
因此,经过漫长的进化,机体只在进食后才明显上调胆固醇的合成,而在饥饿状态下则抑制胆固醇的合成。重要的科学问题来了,饥饿状态下机体抑制胆固醇合成的调控机制一直是代谢领域悬而未决的基础问题。
全面而深入的机制解析
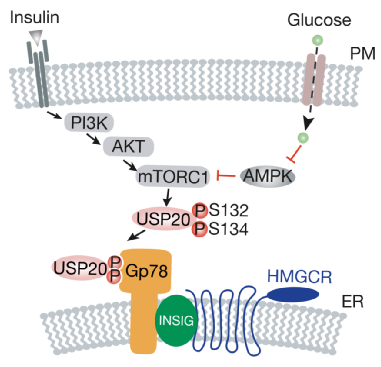
研究人员发现,喂食小鼠高糖低脂食物后,合成胆固醇的主要器官肝脏中的胆固醇合成途径的关键限速酶HMGCR的蛋白量显著增加。
通过一系列生化细胞学实验,他们发现HMGCR蛋白含量的增加是由于其经由泛素-蛋白酶体途径的降解减少导致。
结合体外生化实验,他们证实肝细胞胞质中的去泛素化酶活性增强,导致HMGCR蛋白的泛素化水平下降,是HMGCR蛋白稳定性增加的主要原因。基于此,他们筛选了70多个已知的去泛素化酶,最终锁定了去泛素化酶USP20。
研究人员进一步发现,小鼠进食后血液中显著升高的葡萄糖和胰岛素,协同激活mTORC1,后者进而直接磷酸化USP20蛋白。
mTORC1介导的磷酸化虽然不影响USP20酶活性,但是可以促使USP20结合HMGCR蛋白复合物,促进HMGCR蛋白的去泛素化,提高HMGCR蛋白的稳定性,最终上调胆固醇的合成。至此,研究者全面深入地解析了饥饿状态下机体抑制胆固醇合成的调控机制。
重要技术和方法的运用
按理说,仅仅依靠生化细胞学实验技术就足以阐明分子机制。但是,由于代谢的复杂性,很多生化细胞学上的发现不一定能在动物个体上重现。也就是说,对于单个细胞很重要的代谢调控机制对于整体动物不一定很重要。
因此,对于肿瘤和代谢等方面的研究,动物实验不仅是对于生物细胞学实验的补充,也是功能研究不可或缺的一环。毕竟,整体动物展现出来的表型才与人体更接近,也就更有价值。
在本项研究中,研究人员依靠多种基因敲入和基因敲除小鼠,令人信服地证明了在动物水平mTORC1-USP20-HMGCR信号轴依然是饥饿状态下机体抑制胆固醇合成的主要通路。
有助于相关药物开发
最后就是是否有助于药物开发了。目前,代谢紊乱引发的糖尿病、肥胖和心血管疾病等严重损害人类的健康。阐明新的代谢调控通路很可能会打开一扇治疗代谢性疾病的大门。
然而,目前基于此成功开发的新药仍然很少。其中,他汀类药物的发现无疑是其中的佼佼者。美国德克萨斯西南医学中心的Joseph Goldstein和Michael Brown因共同揭示了胆固醇代谢调节机理而获得了1985年的诺贝尔生理学或医学奖,他们的发现直接催生了他汀类药物的广泛应用,极大地降低了心血管疾病对人类健康的损害。
在本项研究中,为了明确USP20可否作为代谢性疾病的靶标,研究人员利用USP20抑制剂干预肥胖小鼠,发现USP20抑制剂能够显著减轻小鼠体重,降低血液胆固醇和甘油三脂水平,并显著提高胰岛素敏感性。
另外,抑制USP20的活性后还能增加产热。总之,靶向USP20的活性有助于治疗高胆固醇血症、肥胖、糖尿病等代谢性疾病。

综上所述,本项研究,研究人员针对代谢领域一个悬而未决的重大问题,利用一系列精妙的生化细胞学实验,阐明了背后的分子调控基础,进而利用一系列小鼠模型明确了该通路对机体代谢的影响,最后基于该通路找到了干预代谢性疾病的有效药物。
参考文献
Lu, X.Y., Shi, X.J., Hu, A., Wang, J.Q., Ding, Y., Jiang, W., Sun, M., Zhao, X., Luo, J., Qi, W., et al. (2020). Feeding induces cholesterol biosynthesis via the mTORC1-USP20-HMGCR axis. Nature 588, 479-484.
文章来源:挑圈联盟













