Identification of an Immune-Related Gene Signature Based on Immunogenomic Landscape Analysis to Predict the Prognosis of Adult Acute Myeloid Leukemia Patients
基于免疫基因组学景观分析的免疫相关基因特征鉴定,以预测成人急性髓系白血病患者的预后
发表期刊:Front Oncol.
发表日期:2020 Nov 20
影响因子:4.137
DOI: 10.3389/fonc.2020.574939
01
研究背景
急性髓细胞性白血病(AML)是一种造血系统恶性肿瘤,其特征是高度异质的分子病变和细胞遗传异常。目前最常用的预测AML患者预后的方法是ELN基因风险分层系统。但由于患者可能表现出不同的结果和不同的存活时间,现有预后系统的准确性尚未确定。
随着基因测序技术的快速发展,基于多基因整合、ncRNA整合、自噬相关基因整合或免疫相关基因(IRG)的预后信号已经在各种类型的如果肿瘤中被构建和验证。其中一些风险评分信号在预测癌症患者预后方面表现出极大的敏感性和特异性,可作为指导个体化治疗的潜在工具。
在本研究中,作者通过使用TCGA和GTEx数据库分析AML的预后免疫景观,确定了27个枢纽免疫基因,并构建了一个6-IRGs特征签名来预测AML患者的预后。
02
方法和材料
表达谱矩阵:1)143个AML样本来自于TCGA;2)GEO数据:GSE37642,选择有生存特征的样本,共128个;3)192个正常全血样品来自于GTEx
IRG列表:来源于InnateDB数据库(http://www.innatedb.com/)
数据标准化:R软件包limma的“normalize between array”功能
差异基因分析:R软件包DESeq2,阈值:|log2 (FC)|> 2 和FDR < 0.05,R软件包VennDiagram构建Venn图。
富集分析:R软件包clusterProfiler和enrichplot进行GSEA、GO、KEGG富集分析,KEGG和GO分析的截止P值和Q值均为0.05,GSEA的截止P值为0.05。
单因素cox回归分析并构建与生存相关的IRG的PPI网络并使用Cytoscape展示。R软件包forestplot绘制森林图。
多因素cox回归分析(R软件包survival)和LASSO回归分析(R软件包glmnet)建立预后模型。
Kaplan-Meier曲线展示预后差异,ROC曲线评估模型性能。
03
结果展示
01 - 识别在AML中差异表达的IRGs
首先筛选AML样本与正常样本件的DEG共10288个,接下来取IRG与DEG的交集,最终鉴定出604个AML相关的IRGs(图1C),而其中138个是上调的,466个是下调的。AML相关IRGs如图1A、B所示。
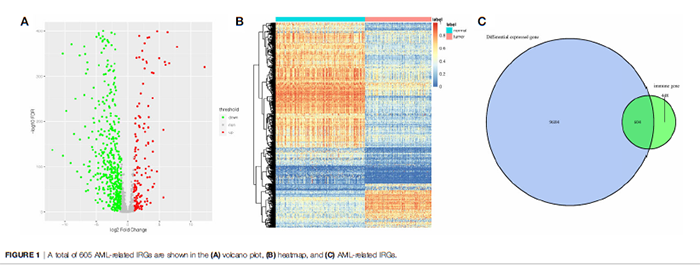
图1 筛选与AML相关的差异IRGs
02 - 差异表达的IRGs的生物功能分析
对604个IRGs进行GO和KEGG分析。GO分析(图2A-C)发现这些基因在receptor binding、cytokine activity、receptor signaling protein activity、interleukin binding、immune system process、apoptosis and programmed cell death过程中显著富集,且这些基因主要富集在细胞外区域。KEGG分析(图2D)发现IRGs富集在免疫通路中, 例如the cytokine-cytokine receptor interaction pathway、Toll-like receptor pathway、Jak-Stat signaling pathway and chemokine signaling pathway。
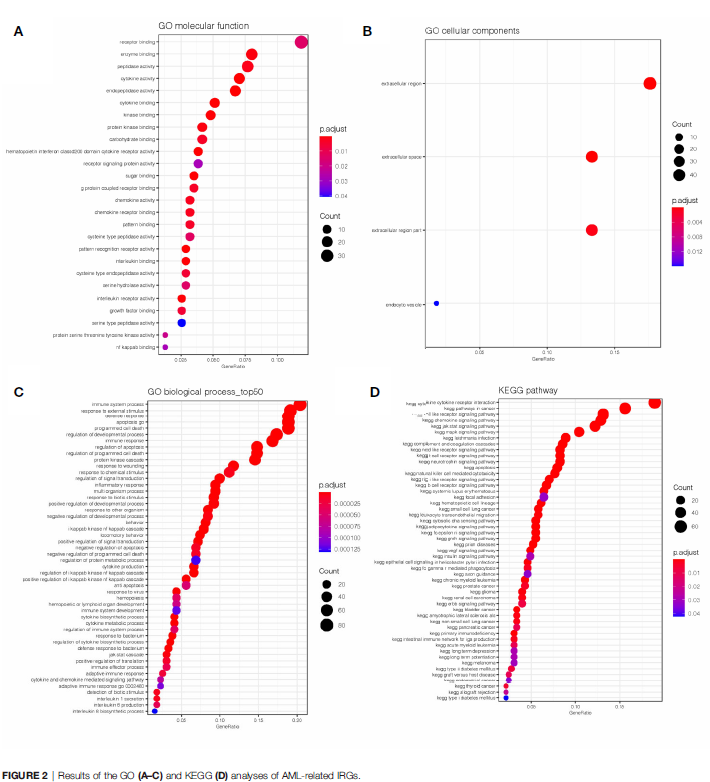
03 - 识别与OS相关的IRGs和Hub IRGs的鉴定
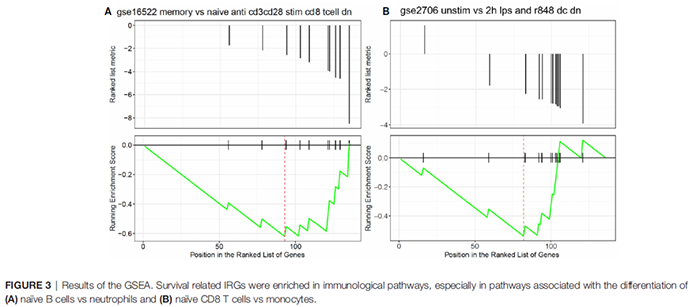
图3 生存相关IRGs富集的途径
构建IRG的PPI网络用于识别中心IRG。在136个与生存相关的IRG中,网络中度数最高的5%被视为中心IRG。总共确定了24个中心IRG(图4A)。CDK6、MMP7和SRXN1在AML样本中上调,而其他基因均下调。大多数枢纽基因的失调与不利的预后有关。
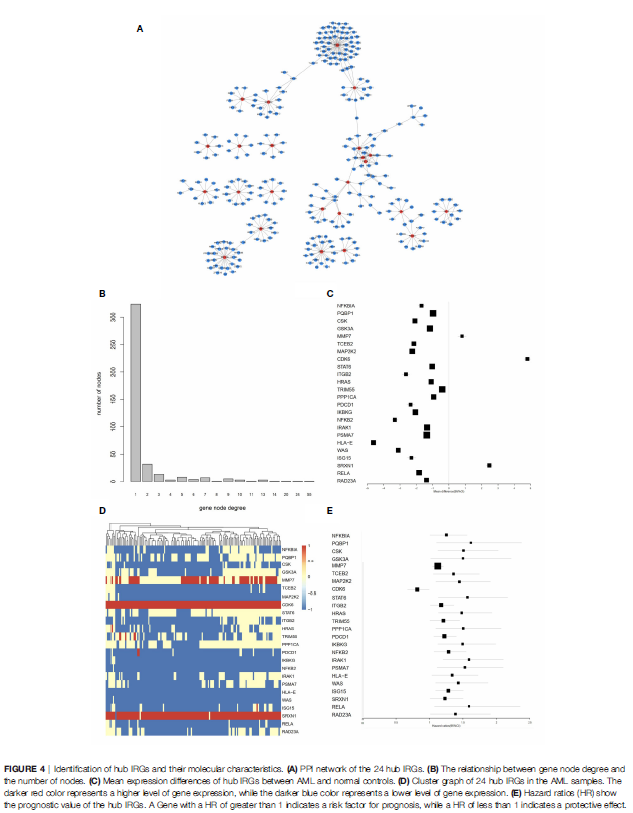
图4 识别中心IRGs及其分子特征。
作者还构建了TFs与Hub IRGs之间的关系网络,以确定Hub IRGs的分子机制。单变量Cox回归分析发现,66个TFs与AML的OS相关(图5A)。使用热图(图5B)显示了这66个TFs在AML样本和正常对照中的基因表达。构建了24个中枢IRGs和66个TFs之间的调节网络(图5C)。
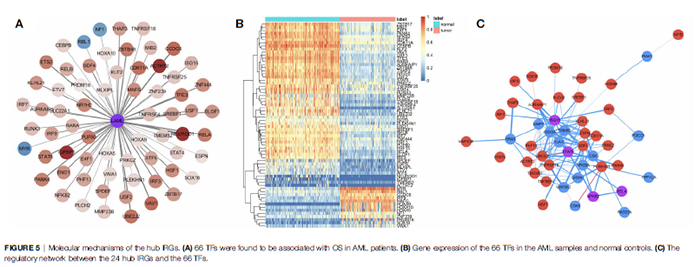
图5 Hub IRGs的分子机制
04 - 使用Hub IRGs构建预后风险模型
利用多变量和LASSO回归分析的结果,确定了6个IRG。6个IRGs在高风险评分组和低风险评分组中的表达情况用热图显示(图6A)。
作者最终得到了一个风险评分公式:
Risk score = 0.3827 * expression of CSK+ 0.1383 * expression of MMP7 + 0.3114 * expression of IKBKG + 0.1589 * expression of PDCD1 + 0.3812 * expression of PSMA7 + 0.2127 * expression of ISG15
根据风险评分的中位数,将患者分为高风险组和低风险组,风险评分与生存状态的关系见图6B、C。如图6D所示,用Kaplan-Meier曲线证明高风险组患者的OS明显短于低风险组患者[P=0.00019,HR=1.89(1.26-2.83)]。ROC曲线显示,风险评分特征的AUC为0.7146,表明IRG特征对AML的生存预测具有中等潜力(图6E)。接下来作者使用外部数据集GSE37642对风险评分进行验证,结果表明IRG特征表现良好(图6F、G)。
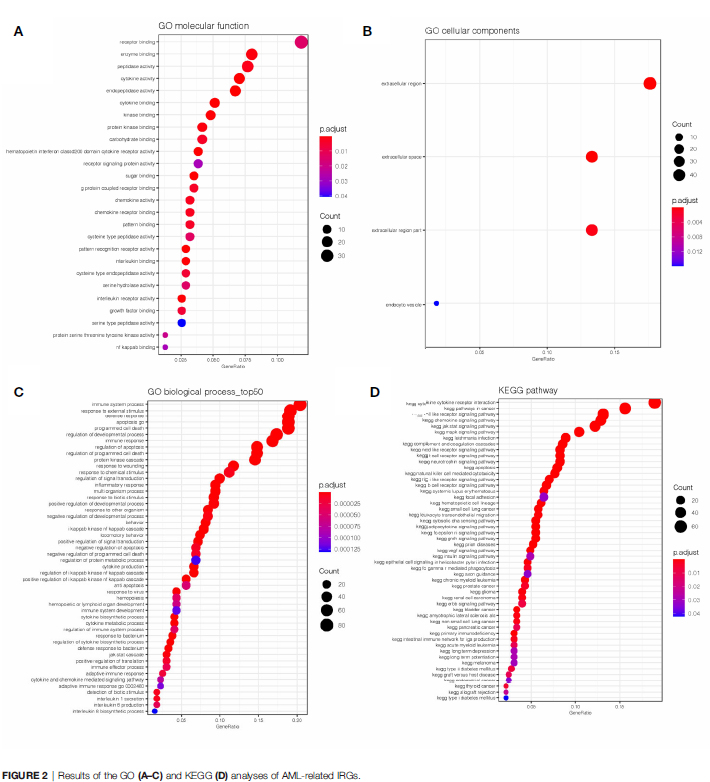
图6 构建6-IRGs的风险模型
05 - 预后风险模型与各临床因素有关
之后作者考虑到年龄和分子遗传特征可能对预后有影响并进行了进一步研究。该预后模型可以进一步区分RAS突变/无RAS突变患者、FLT3突变/无FLT3突变患者、60岁以上患者、染色体正常患者、IDH突变患者、NPM1突变患者的预后(图7A-H),弥补了现有临床预后模型无法进一步区分此类患者的不足。
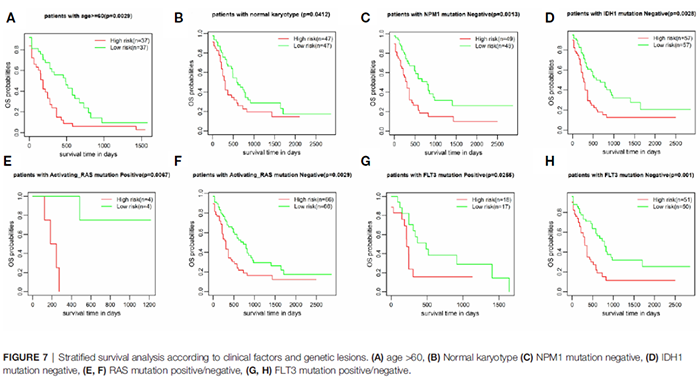
图7 根据临床因素和遗传病变进行分层生存分析
最后,作者利用TCGA-AML数据集的数据进一步研究了6-IRGs特征与临床变异之间的关系,包括年龄、性别、WBC、核型和FAB类别。结果显示,较高的风险评分总是与高龄、IDH突变和M5 FAB类别相关。风险评分与性别、核型、RAS突变、FLT3突变、NPM1突变和WBC之间没有差异(图8A-H)。
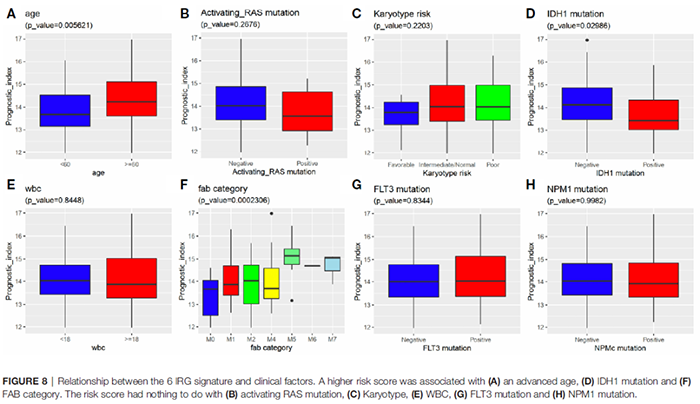
图8 6-IRGs特征与临床因素的关系
04
结论
总之,基于免疫景观分析,构建了6-IRGs特征签名来预测AML患者的预后。该签名根据平均OS成功将患者分层为高危组和低危组。同时,在高危患者中常发现不良的临床预后因素,包括高龄、高WBC和不良核型。AML免疫景观分析发现了新的AML靶点和信号通路,同时该特征提供了一种预测预后的新方法。
以上就是这篇文章的主要内容,在生信研究中,对于非实体瘤的研究结果远少于实体瘤,希望这篇文章能够给研究非实体瘤方向的小伙伴们一些思路~
文章来源:生物学霸













