头颈部鳞状细胞癌(HNSCC)是一种恶性肿瘤,5年生存率低,预后差,具有高侵袭性,高耐药性,经常转移到颈部淋巴结。近几年肿瘤干细胞(CSCs)也被逐渐发现与肿瘤的起始、生长和转移有关,越来越多的证据表明,CSCs可能导致癌症治疗抗药和复发。而有报道发现在CSC中高表PD-L1和维持CSCs自我更新的BMI1,所以肿瘤干细胞与肿瘤免疫联合研究开始受到许多科学家的关注。今天笔者就带来一篇在肿瘤干细胞中的肿瘤免疫研究,这篇报道发表在Cell Stem Cell(IF=20.8),让我们一起来看一下这篇文章的主要工作吧。

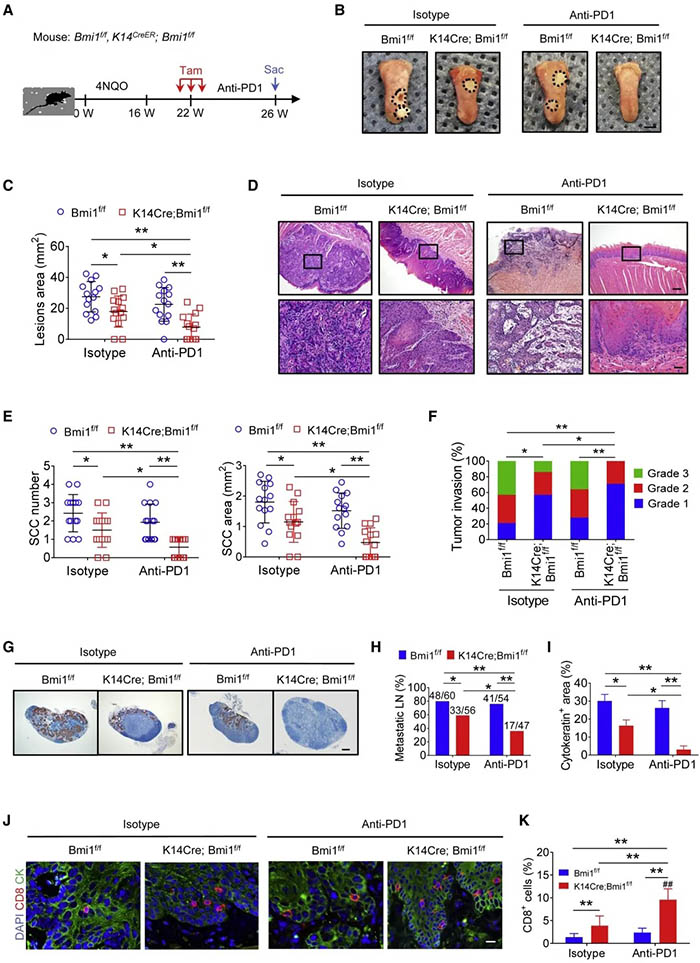
为了检验抗PD1联用顺铂是否能消除HNSCC的BMI1+CSCs,作者在荷瘤小鼠中进行单独用药和联合用药实验,发现联合用药虽然没有增强顺铂的抑制效果,但显著减少HNSCC数量和面积。此外,联合用药也显著降低了HNSCC的侵袭性也减少了淋巴结转移,增加了肿瘤中CD8+T细胞浸润和Bm1-肿瘤细胞凋亡,而BMI1+CSCs则未改变。同时作者发现在单用顺铂和联合用药中可以显著地富集肿瘤中BMI1+CSCs。
结论:抗PD1加顺铂能够有效地杀死非干性肿瘤细胞, 而BMI1+CSCs可以逃避CD8+T细胞的杀死。
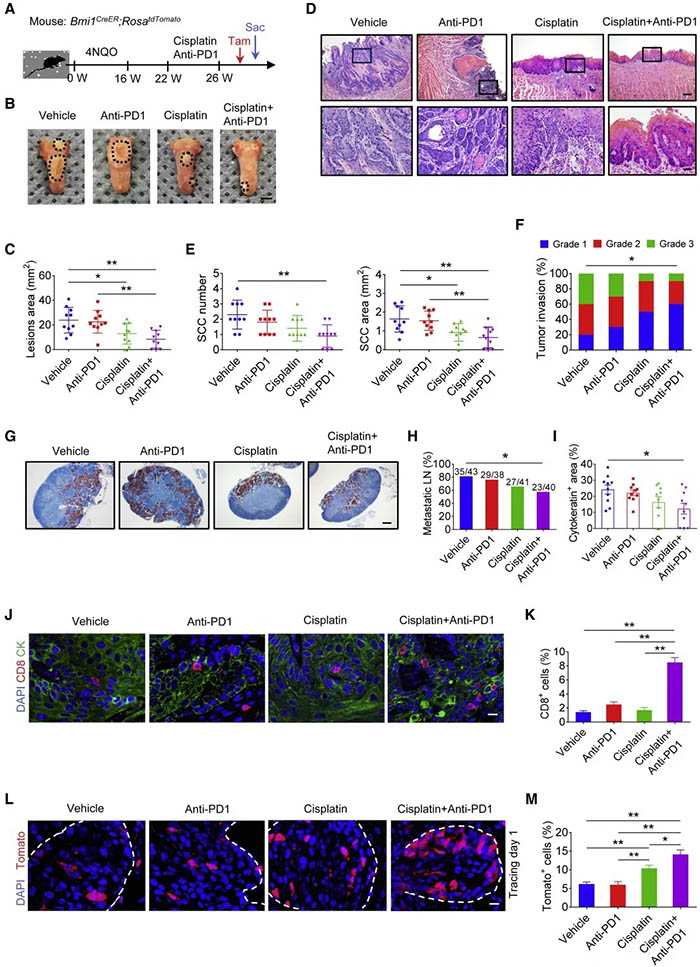
随后作者利用了BMI1抑制剂PTC209处理肿瘤细胞,证实抑制剂可降低BMI1在肿瘤中的表达。同样对荷瘤小鼠进行抑制剂和抗PD1单独和联合用药。结果发现联合用药显著减少肿瘤数量、面积,侵袭性和淋巴结转移,也可以效地诱导非干性的HNSCC凋亡。联合用药也使CD8+T细胞浸润明显增加,同时体内标记显示联合用药能有效地清除HNSCC中的BMI1+CSCs。
结论:抑制剂加抗PD1治疗的肿瘤细胞数量减少并能减少干性肿瘤细胞。
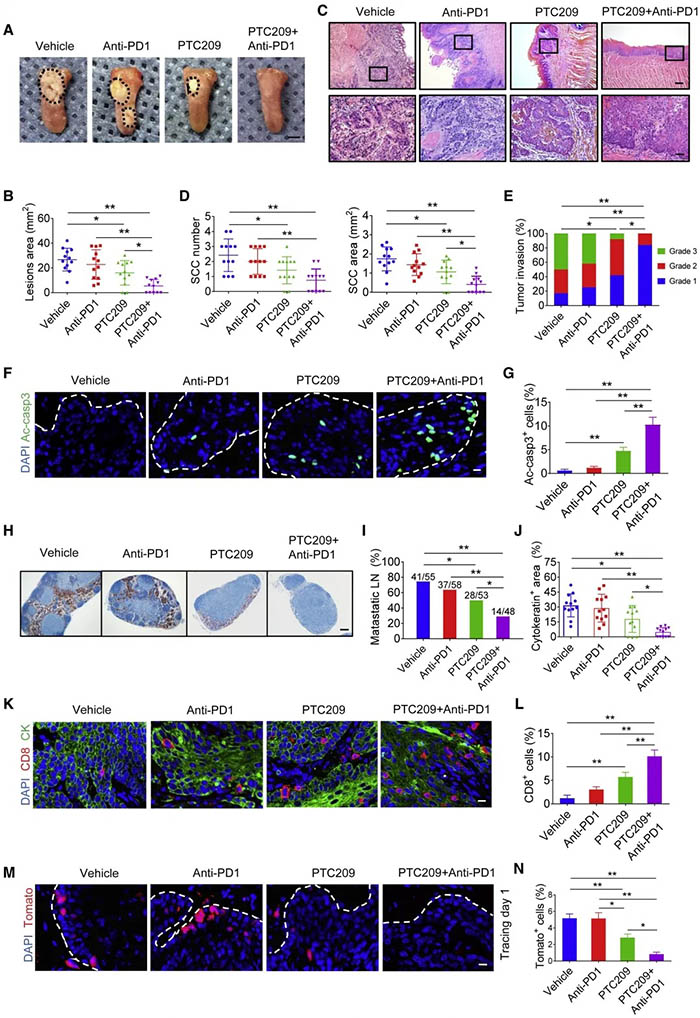
为了测试PTC209+抗PD1介导的抗肿瘤免疫是否需要瘤内CD8+细胞,作者用抗CD8+细胞的抗体同时治疗荷瘤小鼠。免疫组化显示,抗CD8抗体可明显抑制联合用药诱导的CD8+T细胞浸润并且恢复了肿瘤面积及数量,同时也减弱了联合用药诱导的肿瘤细胞生长抑制,凋亡和淋巴结转移。
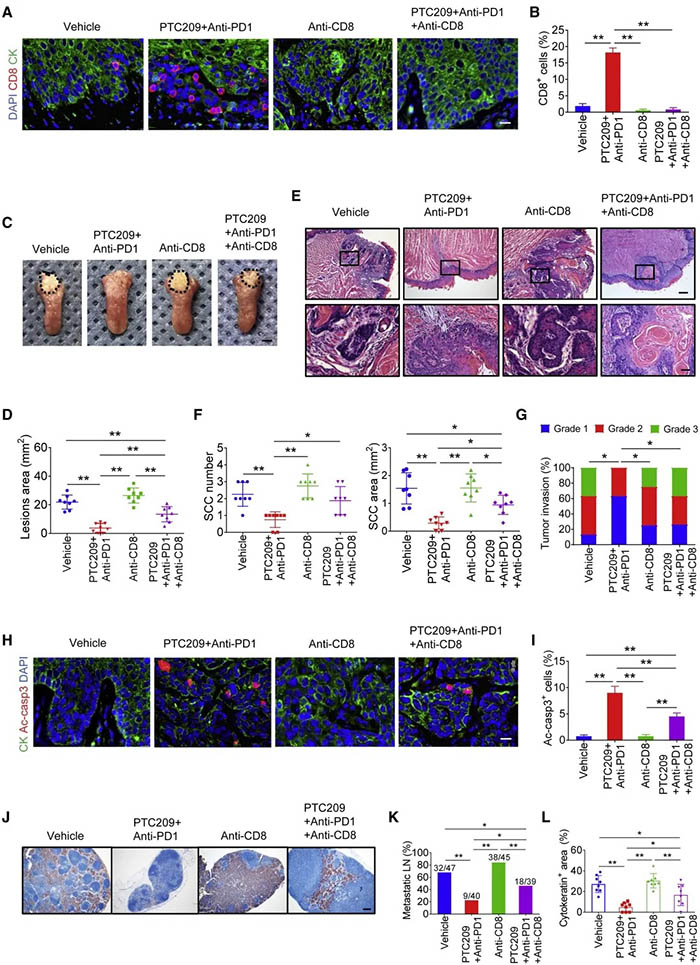
为了进一步确定靶向肿瘤细胞固有的BMI1是否促进CD8+T细胞的浸润,作者构建了BMI条件性敲除小鼠,并验证了HNSCC中BMI1基因被敲除。BMI1KO与抗PD1联用可显著抑制HNSCC的数量、面积,侵袭和淋巴结转移,也能有效地诱导HNSCC凋亡,同时能进一步促进HNSCC 的CD8+T细胞浸润。
结论:肿瘤细胞中BMI1的抑制与PD1的阻断协同作用,通过募集和激活CD8+T细胞来抑制HNSCC的侵袭生长和转移。
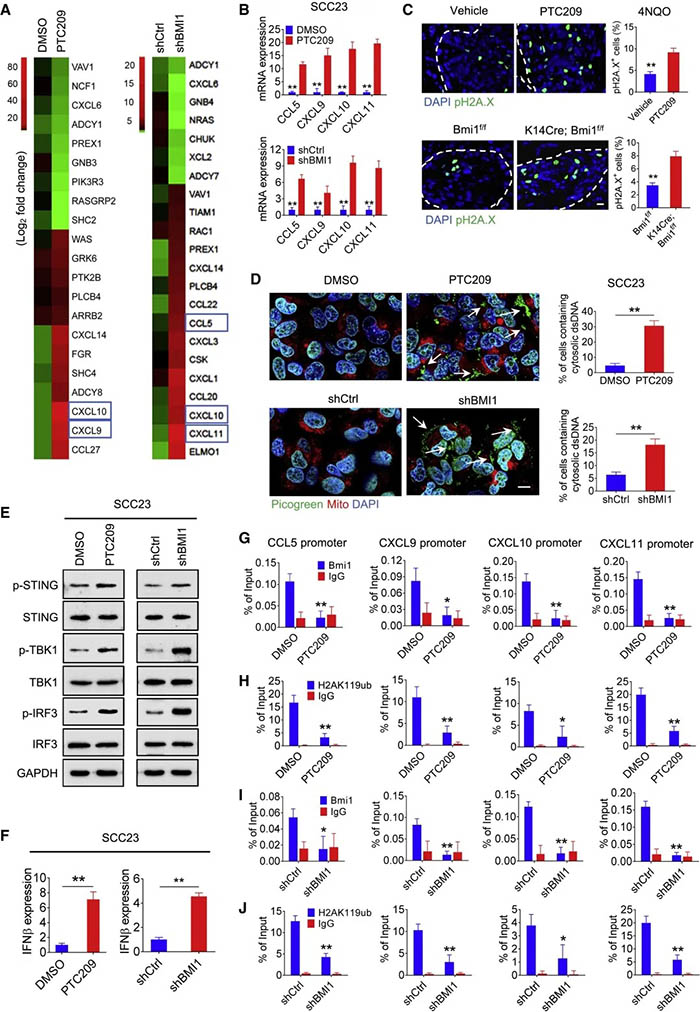
为了进一步阐明BMI1抑制募集CD8+T细胞增强PD1阻断治疗的分子和表观遗传学机制,作者构建了BMI1敲降细胞并进行验证。之后作者进行了RNA-seq,GO富集到免疫应答和趋化相关条目,敲降细胞显著增加了干扰素调节的趋化因子(CCL5、CXCL9、CXCL10和CXCL11),它们促进CD8+T淋巴细胞向肿瘤部位的招募, qRT-PCR和ELISA验证。同时作者还检测了到人HNSCC组织中BMI1与CD8、CCL5和CXCL10呈负相关。
有报道称 BMI1被招募到双链DNA断裂(DSB)位点,使pH2A.X泛素化促进DSB的修复。随后作者观察到抑制剂处理和KO鼠的HNSCC中DNA损伤标志物pH2A.X显著增加,表明抑制BMI1可诱导HNSCC的DNA损伤。作者为了检测BMI1抑制引起的DNA损伤是否导致胞浆dsDNA的积聚,使用dsDNA特异的活性染料PicoGreen进行染色。用抑制剂和敲降后,发现胞质中dsDNA积累。作者利用Wb发现抑制BMI1诱导了细胞中STING、TBK1和IRF3的磷酸化,激活了IFNb,同时磷酸化IRF3显著增加,证实抑制BMI1激活了体内cGAS-STING-IRF3通路,与其他报道一致。
作者利用ChIP-qPCR发现BMI1特异性地位于CCL5、CXCL9、CXCL10和CXCL11启动子上。抑制剂处理降低了BMI1与启动子结合水平,同时也显著降低了CCL5、CXCL9、CXCL10和CXCL11启动子上的H2AUb标记水平,表明抑制BMI1也可以内在地抑制趋化因子的表达。
结论:抑制BMI1可以诱导cGAS-STING信号激活IRF3介导的转录,同时可以消除趋化因子启动子上的抑制性H2AUb的结合,两种相互关联的机制来刺激肿瘤细胞中的趋化因子。
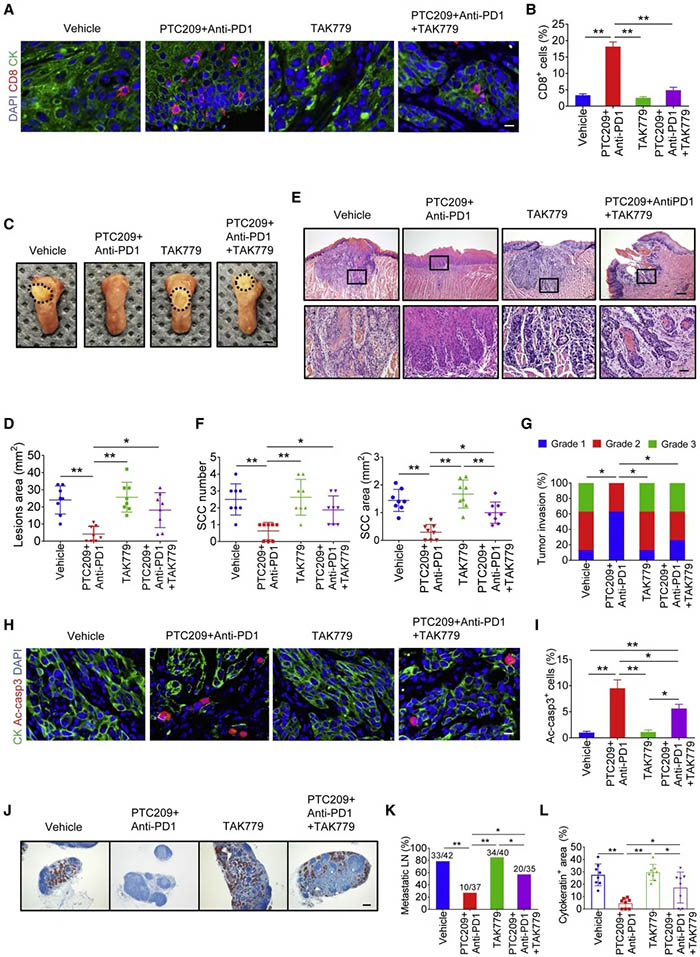
随后作者测试抗PD1和抑制剂介导的抗肿瘤免疫是否需要IFN调节的趋化因子和CD8+T细胞的募集,作者同时用CCR5和CXCR3的抑制剂TAK779治疗荷瘤小鼠,这两种受体分别是CCL5、CXCL9、CXCL10和CXCL11的受体。免疫组化结果显示,TAK779可显著抑制抗PD1+PTC209诱导的HNSCC中CD8+T细胞的浸润,恢复被联合用药所抑制的肿瘤面积并且逆转了HNSCC的生长抑制作用,减弱了HNSCC凋亡和淋巴结转移的抑制作用。
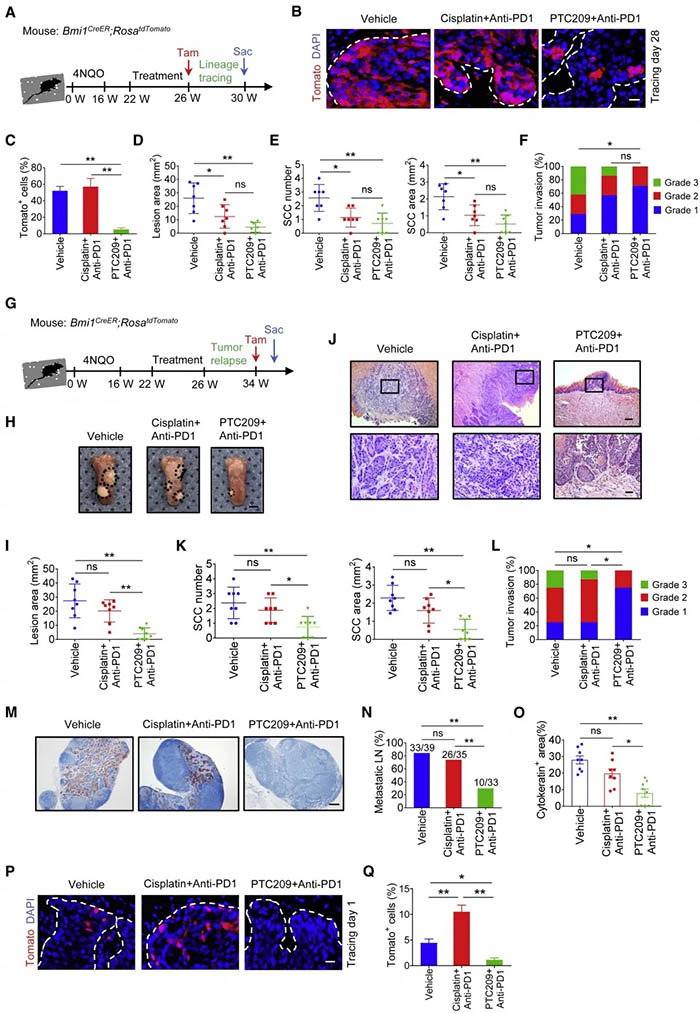
为了确定BMI1+CSCs是否与HNSCC复发有关,进行了体内谱系追踪。示踪小鼠可以追踪BMI1+及其子代细胞,示踪小鼠荷瘤后用抗PD1+顺铂、抗PD1+PTC209和对照处理。结果显示PD1抗体联合顺铂治疗的HNSCC中,70%以上的肿瘤细胞为BMI1+细胞,而在使用抗PD1+PTC209组中,阳性细胞减少,并且抗PD1联合PTC209治疗HNSCC的复发率更低, 提示富集的BMI1+CSCs是HNSCC复发的原因。
作者使用更长时间的示踪发现与抗PD1+顺铂相比,抗PD1+PTC209的病灶面积更小,而对照组和抗PD1+顺铂治疗组中HNSCC的数量、面积和侵袭能力没有差异,从而证实了抗PD1+顺铂治疗组HNSCC容易复发。同时抗PD1+PTC209对HNSCC生长的抑制作用持续存在,且淋巴转移数量显著减少。体内标记BMI1+CSCs显示,在消退期HNSCC中,抗PD1+PTC209能有效地消除BMI1+CSCs,而在用抗PD1+顺铂治疗的复发HNSCC中,BMI1+CSCs仍然存在。
笔者总结
这篇文章初看觉得套路简单,还在想怎么能发到干细胞的顶刊上,但是细细读完之后,发现作者整体思路清晰,从最开始的科学问题出发,提出了领域内的难点和临床问题,验证了虽然顺铂和抗PD-1联用对肿瘤有效,但其只能杀死非干性肿瘤细胞,会使肿瘤极易复发。有了这个科学问题作为导向,接下来沿着领域内研究的热点BMI1对肿瘤干细胞自我更新的影响开始进行研究。并且发现在与抑制剂连用后可以将干性肿瘤细胞杀死,并且从肿瘤免疫方面解释了部分机制。在达到创新度之后,工作量也丝毫不差,分别用了体内示踪小鼠和条件性敲除小鼠来对BMI1进行验证,从体内和体外两方面佐证得到的结果。更重要的是这篇文章在实验分组方面非常的严谨细致,多个分组实验使结果清晰明了。所以有要做肿瘤干细胞和肿瘤免疫的小伙伴可以参考这篇文章,说不定会给你带来许多思路和启发。
来源:科研讲坛













