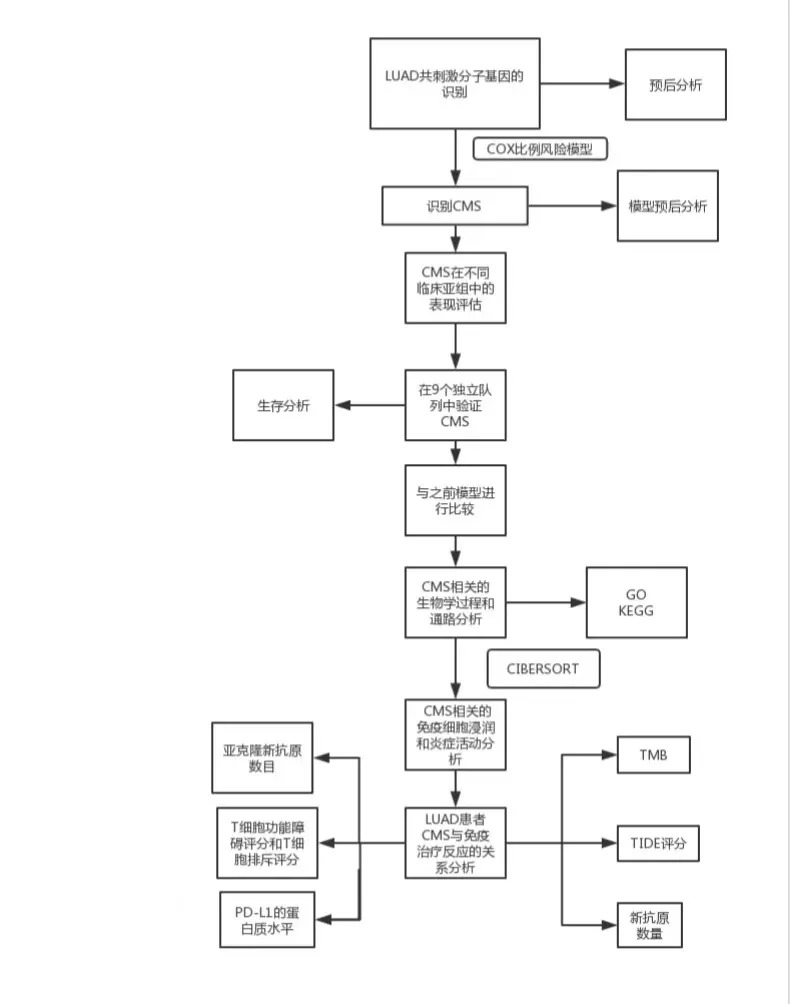
小编今天解读的这篇文章是2020年发表在杂志OncoImmunology(IF: 5.869)上,题目为Identification of a costimulatory moleculebased signature for predicting prognosis risk and immunotherapy response in patients with lung adenocarcinoma。作者对LUAD患者进行了共刺激分子景观分析。建立了一个可靠的,临床上可行的预后特征模型,命名为CMS,并确定了该特征潜在的免疫相关机制。重要的是,CMS与经过充分验证的免疫疗法生物标记物密切相关。CMS的预测能力将有助于患者的个性化治疗。
背景:共刺激分子在增加抗肿瘤免疫反应中起重要作用,靶向这些分子的抗体被认为是有前途的辅助癌症免疫疗法。作者的目标是对肺腺癌(LUAD)患者中B7-CD28和TNF家族的共刺激分子进行首次全面探索,并产生基于共刺激分子的信号特征(CMS)以预测存活率和对免疫疗法的反应。
方法:作者在10个不同的队列中纳入了1549例LUAD病例,包括TCGA的502个样本。验证集包括来自8个GEO数据集的970例病例,以及具有qPCR数据的77个冷冻肿瘤组织。还探讨了CMS的潜在机制和预测性免疫治疗能力。
结果:作者使用生物信息学方法构建了基于5个基于共刺激分子的基因特征(CD40LG,TNFRSF6B,TNFSF13,TNFRSF13C和TNFRSF19),该方法将患者OS分为高风险组与低风险组。多变量Cox回归分析认为CMS是独立的预后因素。不出所料,CMS在分层队列和不同的验证队列中具有显著的预后意义。此外,预后meta分析显示CMS优于先前的特征。高风险和低风险组的样本表现出明显不同的肿瘤浸润性白细胞和炎症活性。重要的是,作者发现CMS评分与多种免疫疗法生物标志物密切相关。
结论:作者对LUAD患者进行了首次最全面的共刺激分子景观分析,并建立了可用于临床预后和免疫疗法反应预测的临床可行的CMS,这将有助于进一步优化癌症的免疫疗法。
1. LUAD共刺激分子基因的概况及其预后意义
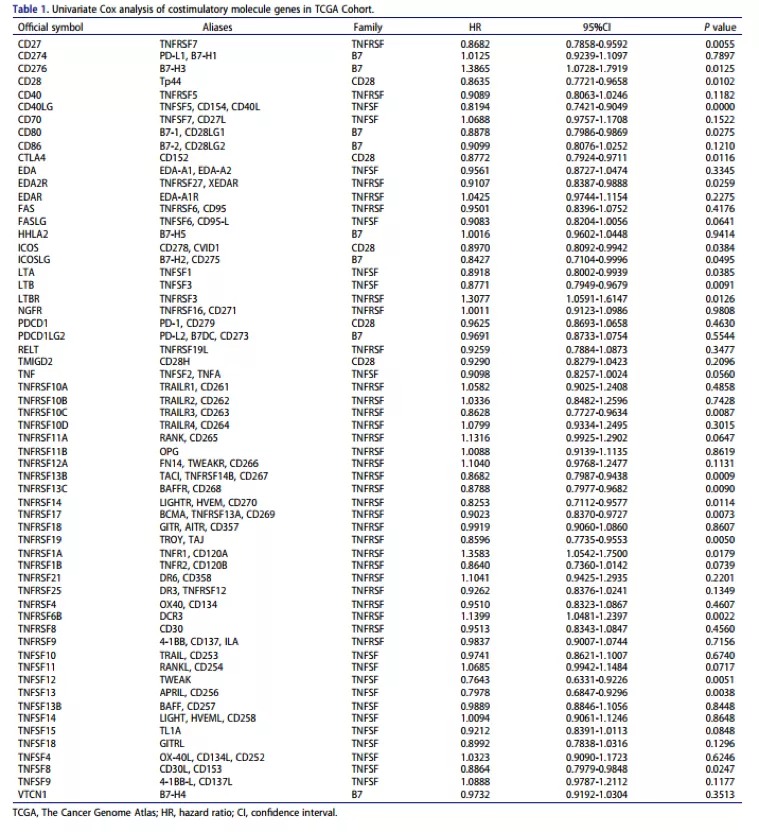
从TCGA LUAD数据中共分离出60个共刺激分子基因,该基因由13个定义完善的B7-CD28家族共刺激分子,13个和47个TNF家族共刺激分子组成。如下表所示:基于TCGA数据集的相关分析表明,大多数共刺激分子与其他分子高度相关。然后,将502位具有60种共刺激分子表达数据和来自TCGA数据的OS信息的LUAD患者用于评估这些候选基因的预后意义。进行了单变量cox比例风险回归分析,结果显示23个基因与OS显著相关。在重要基因中,四个基因(CD276,LTBR,TNFRSF1A和TNFRSF6B)被认为是危险因素,HRs(HR)> 1,还有19个基因(CD27,CD28,CD40LG,CD80,CTLA4,EDA2R,ICOS,ICOSLG,LTA被认为是危险因素, LTB,TNFRSF10C,TNFRSF13B,TNFRSF13C,TNFRSF14,TNFRSF17,TNFRSF19,TNFSF12,TNFSF13和TNFSF8为保护因子)。2. 识别CMS以进行预后分析
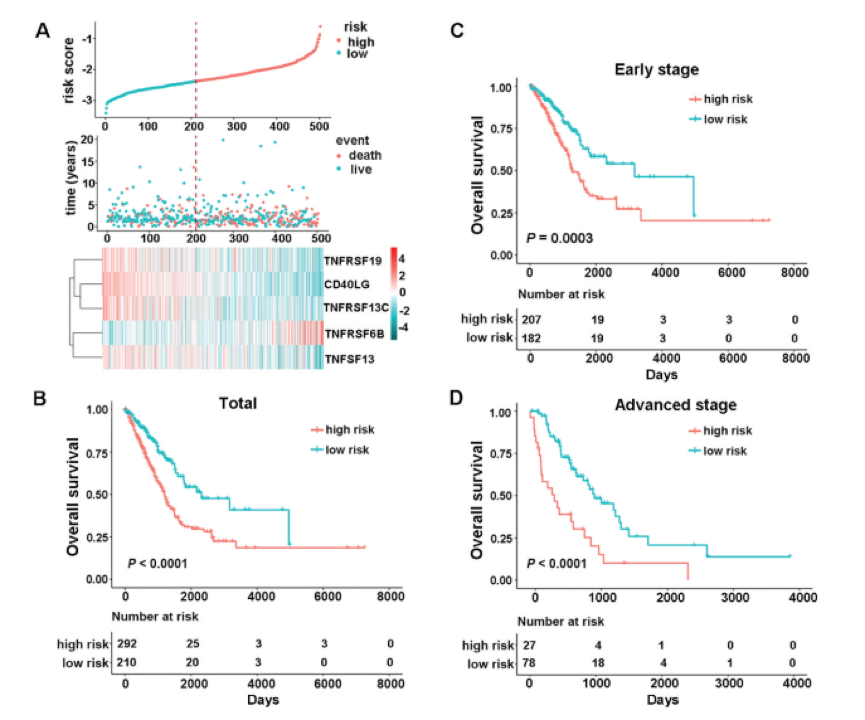
随着针对肺癌共刺激因子的ICI在临床应用中的巨大成功,作者寻求建立用于预后的CMS。然后使用逐步Cox比例风险回归模型筛选出多余的候选基因并构建预后模型。利用502例患者的预后信息和23个重要候选基因的相应表达,逐步方法最终筛选出5个基因的组合。然后,作者根据基因表达水平为LUAD患者开发了风险评分公式,以预测患者的存活率:风险评分=(-0.1075×CD40LG)+(0.1418×TNFRSF6B)+(-0.1603×TNFSF13)+(-0.1069×TNFRSF13C )+(-0.0803×TNFRSF19)。下图A显示了五个基因的表达,风险评分的分布以及每个患者的生存状态。接下来,作者根据最佳临界点(临界值= -2.3834)将TCGA中的所有患者分为高风险组(n = 292)和低风险组(n = 210)。作者发现高风险组的患者的OS显著恶化,如下图B所示。当作者将特征进一步应用于不同的临床分期时,结果表明仍然有效。具体而言,我们观察到早期和早期阶段(第一阶段和第二阶段)和晚期疾病(III和III期)的高风险组和低风险组之间的OS时间显著不同,如下图C和D所示。
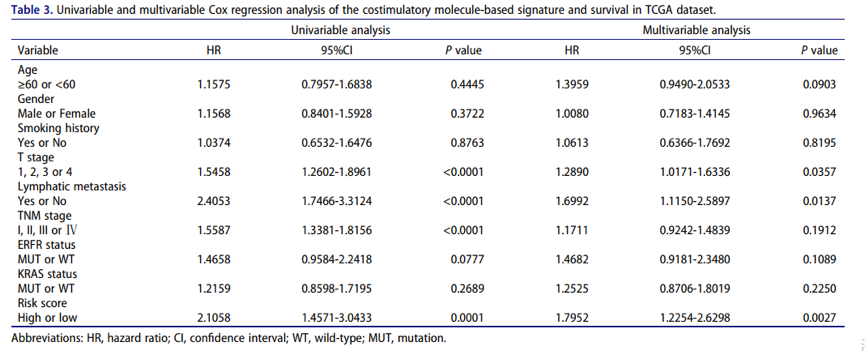
为了进一步探讨基于特征的风险评分是否是LUAD患者的独立因素,作者在TCGA数据库中进行了单变量和多变量Cox回归分析。多元Cox回归模型的结果证实,风险评分是一个重要因素,与年龄,性别,吸烟史,临床分期和突变(MUT)无关。如下表所示:
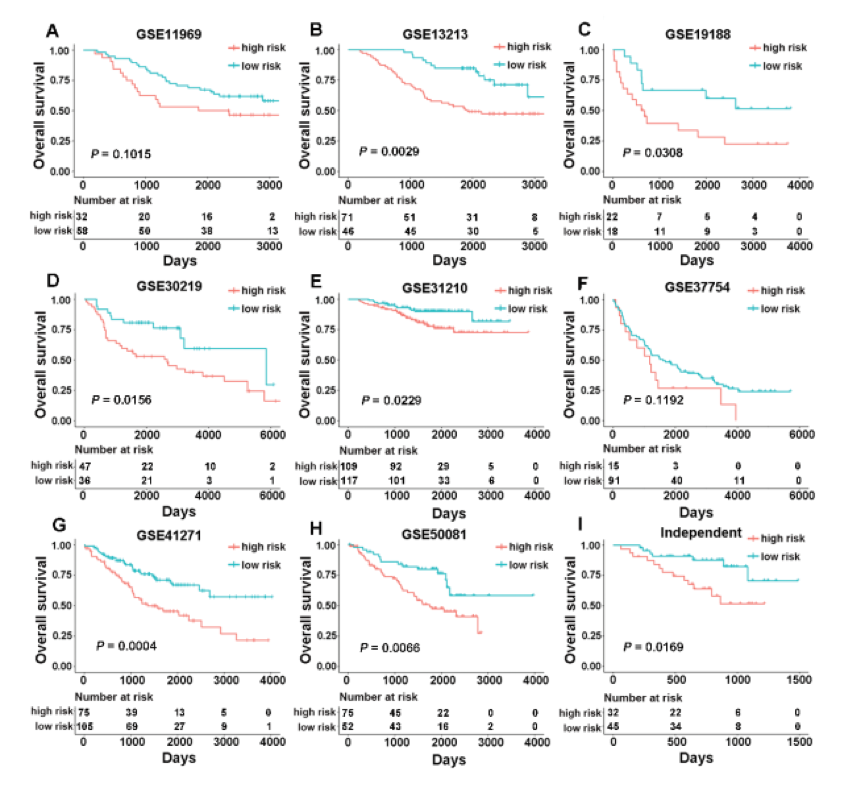
性别,年龄,吸烟史和MUT状态是影响TME的因素,尤其是免疫检查点的表达。因此,根据以下参数,将TCGA的患者分为不同的亚组:性别(男性或女性),年龄[年龄较大(年龄≥60岁)或年轻(年龄<60岁)],吸烟(吸烟者或不吸烟者)和MUT状态 [EGFR宽型(WT),EGFR MUT,KRAS WT,KRAS MUT或EGFR / KRAS WT]。根据相同公式的风险评分,将所有不同亚组的患者分为高风险和低风险组。结果显示,与配对的低风险组相比,所有高风险组的OS均显著不同。为了确定源自TCGA队列的CMS是否强大,作者首先在八个独立的公共验证队列中评估了其性能。这些由剩余的GSE11969,GSE13213,GSE19188,GSE30219,GSE31210,GSE37745,GSE41271和GSE50081数据集组成。CMS使用相同的公式将所有来自不同公共队列的患者分为高风险和低风险组[风险评分=(-0.1075×CD40LG)+(0.1418×TNFRSF6B)+(-0.1603×TNFSF13)+(-0.1069× TNFRSF13C)+(-0.0803×TNFRSF19)]。如下图所示,在大多数GEO数据集中都发现了高风险组和低风险组之间的显著差异。CMS在不同数据集中的不同性能可能是由免疫微环境的不同种族或较高的空间异质性引起的。为了进一步测量特征是否可以在临床实践中使用,作者在一个独立队列中验证了特征,该队列包含77个带有qRT-PCR数据的冷冻组织样本。通过使用相同的模型[风险评分=(-0.1075×CD40LG)+(0.1418×TNFRSF6B)+(-0.1603×TNFSF13)+(-0.1069×TNFRSF13C)+(-0.0803×TNFRSF19)]和最佳割点(cuto ff 值= -0.1300),将患者分为高风险组(n = 32)和低风险组(n = 45)。正如预期的那样,这两组之间的死亡率存在显著差异,如下图I所示。
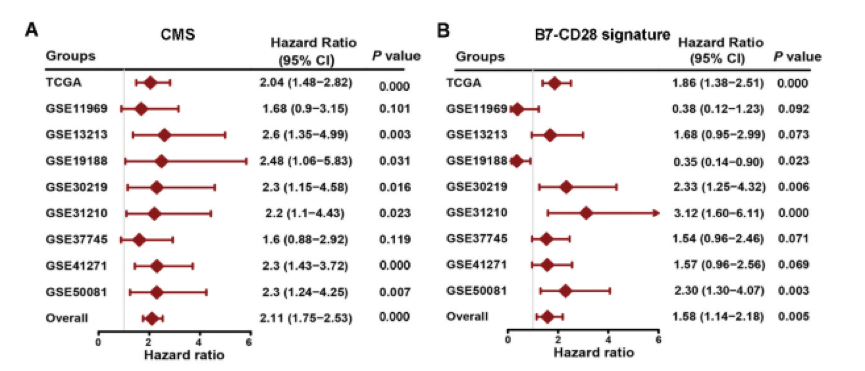
之前的研究基于来自B7-CD28家族的共刺激分子构建了LUAD的特征,其风险评分为0.3313×CD276 – 0.1559×CD28.31。然后,作者全面评估了CMS和B7-B的预后意义。通过检查公共数据集并基于两个不同特征组的九个组(n = 1472)进行预后meta分析,对CD28特征进行分析。如下图A所示,作者的CMS在不同的队列中表现都很好。相反,B7 CD28信号在不同的队列中并不那么稳定,如下图B所示。更重要的是,作者CMS的meta分析合并的HR远大于B7-CD28特征的HR。这些发现表明作者的特征优于以前的模型。
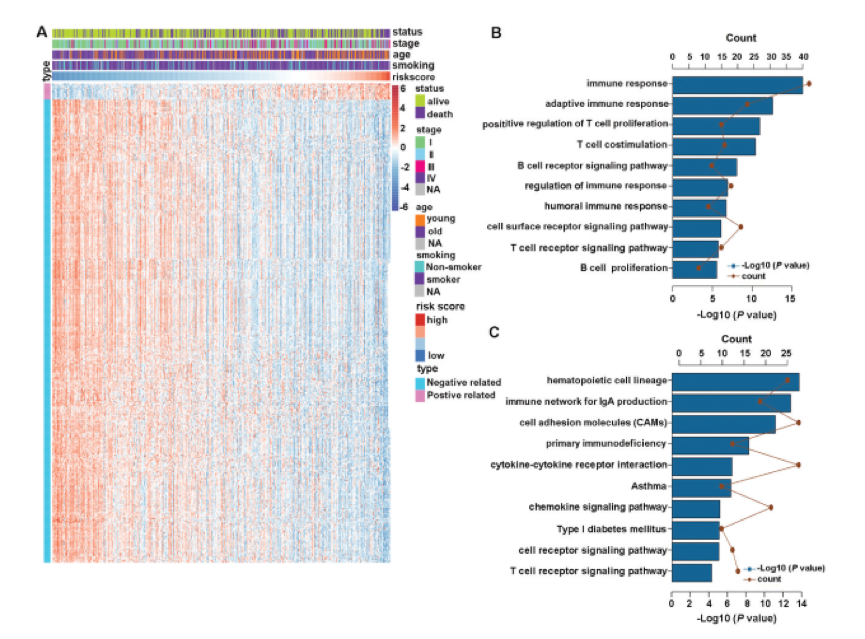
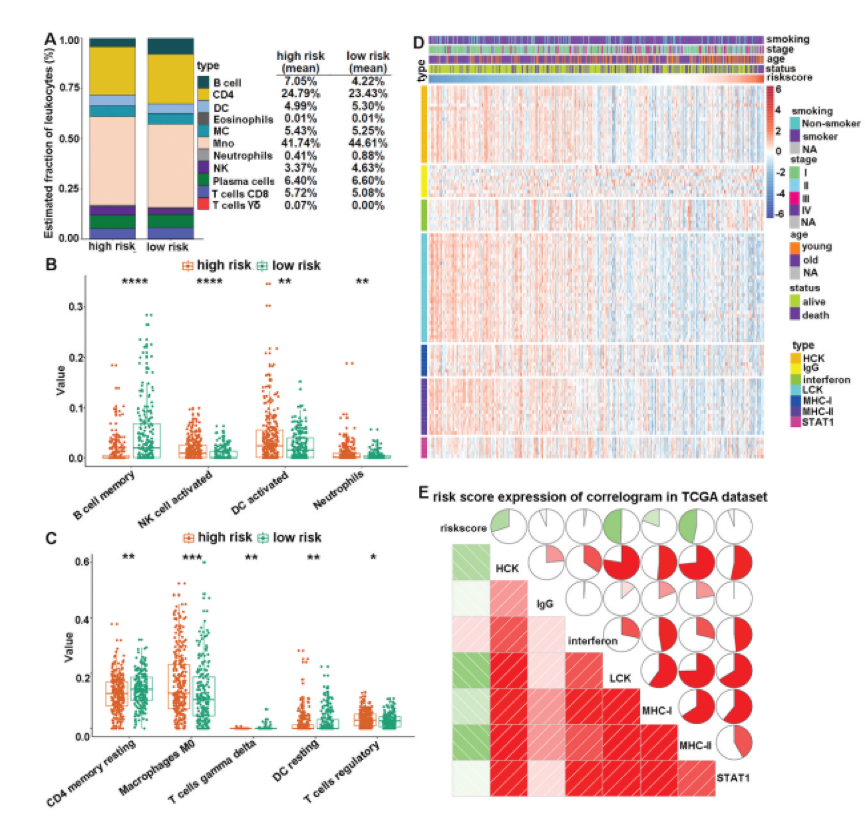
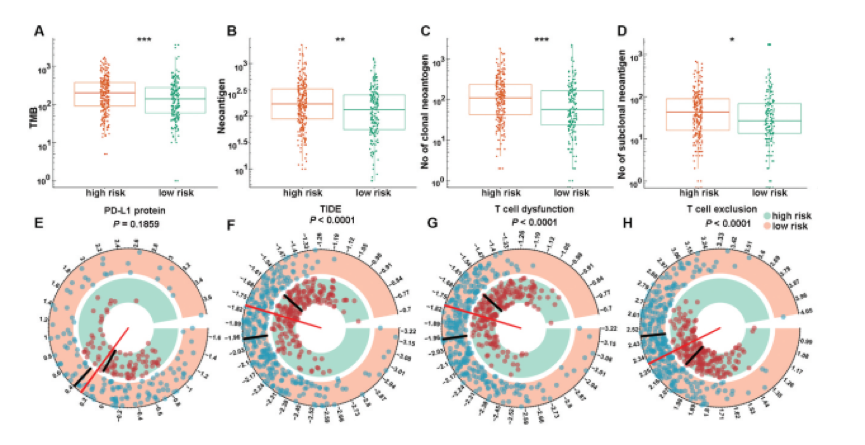
在10个不同的队列中证实了CMS的一致预后表现。这促使作者调查风险评分不同的患者的生物学特征。作者首先筛选出2771个低表达基因,然后从其余部分中提取与风险评分密切相关的基因(Pearson | R |> 0.45,P <.0001) TCGA数据集中的17759个基因。总共筛选出14个正相关基因和399个负相关基因,如下图A所示。然后,选择这些基因进行GO和KEGG分析。结果表明,与特征相关的基因更多地参与了免疫应答的生物学过程,特别是与B细胞和T细胞相关的免疫应答,如下图B所示。KEGG分析进一步证实,这些基因与免疫特异性通路密切相关,如下图C所示。作者首先探讨了CMS与免疫细胞浸润之间的关系。通过CIBERSORT结合LM22计算出LUAD TME中不同免疫细胞的估计分数。结果表明,高风险和低风险患者之间的免疫细胞全景差异很大,如下图A所示。特别的,高风险患者的活化NK细胞,活化树突状细胞(DC),嗜中性粒细胞,巨噬细胞M0,静息DC和调节性T细胞(Treg)的比例明显更高。相反,低风险患者的记忆B细胞,静息CD4记忆T细胞和伽马δT细胞比例较高,如下图B和C所示。接下来,为了增进对CMS相关的炎症活动的了解,作者评估了CMS与7个meta基因簇的关系。它们由104个基因组成,分别代表不同的炎症和免疫反应。下图D显示了所收集基因的表达细节和风险评分。然后,为探索CMS与每个簇的整个核心基因之间的相关性,通过基因集变异分析(GSVA)计算了相应基因簇的表达。最后,根据风险评分核心基因,下图E所示。结果显示,CMS与HCK,LCK,MHC-I和MHC-II负相关。这表明具有高CMS评分的患者具有免疫抑制状态。目前,免疫疗法被认为是LUAD患者的一线治疗。共刺激分子是免疫疗法的主要候选者。因此,作者通过分析CMS与广泛认可的免疫疗法生物标志物之间的相关性,进一步评估了CMS与免疫疗法反应的关联性。总共,作者得到了8个指标,包括TMB,新抗原数量,亚克隆新抗原数目,PD-L1的蛋白质水平,TIDE评分,T细胞功能障碍评分和T细胞排斥评分全面的评估。结果如下所示,下图说明了高风险患者已被区分,具有高水平的TMB,新抗原,PD-L1的蛋白质水平和T细胞排除分数,以及TIDE和T细胞水平低功能障碍评分。这些结果表明,基于CMS高危患者可能受益于免疫疗法,尤其是ICI。作者对LUAD患者进行了共刺激分子景观分析。建立了一个可靠的,临床上可行的预后特征,命名为CMS,并确定了该特征潜在的潜在免疫相关机制。重要的是,CMS与经过充分验证的免疫疗法生物标记物密切相关。因此,CMS可能是用于LUAD患者的预后管理和预测免疫治疗反应的临床有用工具。此公式的预测能力将有助于患者的个性化治疗。