MUC1是一种高度糖化的跨膜粘蛋白,位于上皮细胞的管腔表面,保护它们免受极端因素的影响。在癌细胞中,MUC1表达上调,蛋白质结构、糖基化水平和空间分布发生改变。上调的MUC1参与了多种信号通路的调节,并在肿瘤细胞代谢、细胞凋亡、上皮间质转化和转移中发挥重要作用。MUC1糖基化不足导致新的抗原表位的暴露,这些表位可作为治疗和诊断的特异性靶点。目前,基于MUC1的靶向药物包括单抗、ADC、适配子和肿瘤疫苗,其中一些已经进入临床试验。本文就MUC1结构、表达、在肿瘤生物学功能中的作用以及针对MUC1的治疗药物做一个简单介绍。
MUC1结构与表达
MUC1基因位于染色体1q22上,由7个外显子和6个内含子组成,编码MUCIN家族中的I型跨膜蛋白。通过选择性剪接,MUC1可以形成多种异构体,目前已鉴定出70多种,主要包括MUC1/A、MUC1/B、MUC1/C、MUC1/D、MUC1/X、MUC1/Y等 (图1)。在正常细胞中,MUC1以极性分布分布在上皮细胞的管腔表面,而在肿瘤细胞中,MUC1的分布失去了其极性。
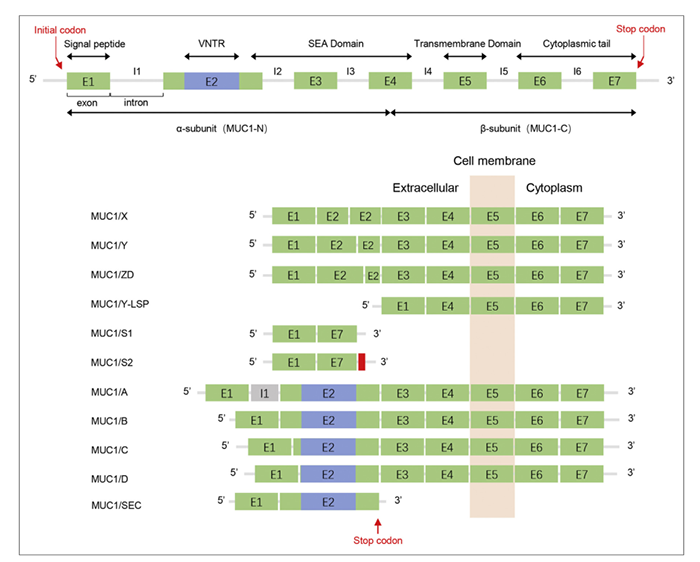
图1. MUC1异构体示意图
MUC1-N包含多个可变数目的串联重复序列(PDTRPAPGSTAP PAHGVTSA)(VNTR)。VNTR形成的多肽骨架为糖基化提供了支架。肽骨架含有一个富含Pro(P)、Thr(T)和Ser(S)的PTS区域,糖链主要通过O-糖苷键与肽骨架上的Ser/Thr相连。在正常细胞中,糖基化隐藏了免疫优势多肽表位,而癌细胞中异常的MUC1糖基化导致免疫优势多肽表位暴露。此外,在肿瘤细胞中,MUC1-N/MUC1-C复合体的破坏导致MUC1-N的脱落和MUC1-C的激活。血液中的游离MUC1-N可以中和MUC1治疗性抗体,使它们无效。
MUC1在多种肿瘤中高度表达,包括乳腺癌、膀胱癌、胰腺癌和卵巢癌,并与预后不良有关。MUC1在正常组织和肿瘤中扮演着完全不同的角色。在正常组织中,正常糖基化的MUC1在上皮细胞表面形成一种保护性屏障,保护它们免受极端环境的影响。在癌细胞中,MUC1异常高表达,异常糖基化改变了细胞内的定位,通过许多信号通路参与多种细胞活动的调节。
MUC1在肿瘤细胞中的作用
MUC1与癌细胞代谢
新陈代谢的转化已成为癌细胞的特征之一。癌细胞对新陈代谢进行重新编程,以维持其能量需求并适应恶劣的肿瘤微环境,同时为强劲的增殖创造条件。MUC1在肿瘤代谢重编程中起重要作用,包括葡萄糖代谢、脂肪代谢、核苷酸代谢、嘧啶代谢和谷氨酰胺代谢(图2)。
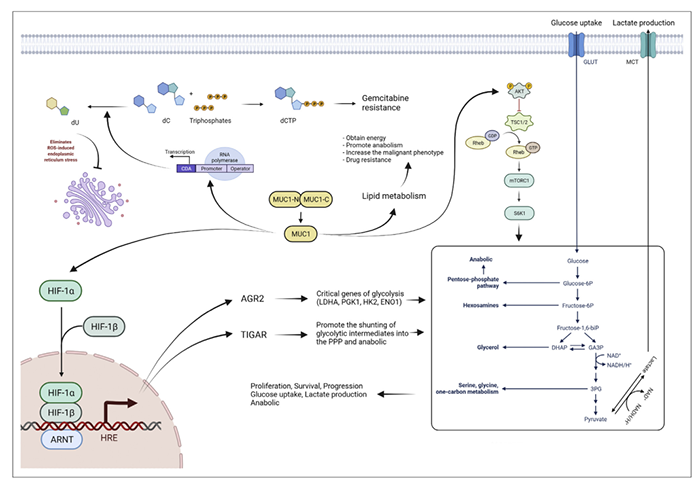
图2. MUC1在肿瘤代谢重编程中的作用
脂代谢紊乱也是癌症最显著的代谢变化之一。癌细胞利用脂类代谢获得能量,促进合成代谢,增加恶性表型。MUC-1通过上调胆固醇和脂肪代谢酶相关基因的转录使得tamoxifen耐药。
MUC1介导的EMT与转移
上皮肿瘤的癌细胞需要一系列过程才能实现远处转移。从上皮细胞到间充质细胞第一次转化的特征是上皮细胞标志物减少,间充质细胞特征增加。这一过程的完成使得细胞脱离邻近细胞的紧密连接,为进入循环做准备。MUC1通过多条途径促进EMT(图3)。
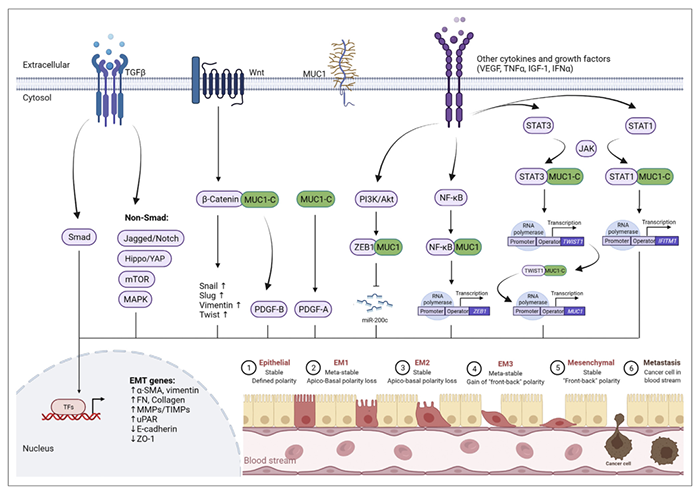
图3. MUC1通过多条途径促进EMT
在肾癌中,SNAI2促进MUC1的表达,反过来,MUC1-C和b-catenin复合体通过与SNAI2启动子区域相互作用诱导细胞的EMT而增加SNAI2的转录活性。ALKBH2通过抑制E-catenin和通过MUC1增加vimentin的表达来促进膀胱癌细胞的EMT。
MUC1与癌细胞凋亡
细胞凋亡是一种受基因控制的正常细胞死亡,在细胞对环境的适应和维持动态平衡方面发挥着重要作用。MUC1可抑制由凋亡物质、化疗药物和雌激素诱导的细胞凋亡(图4)。
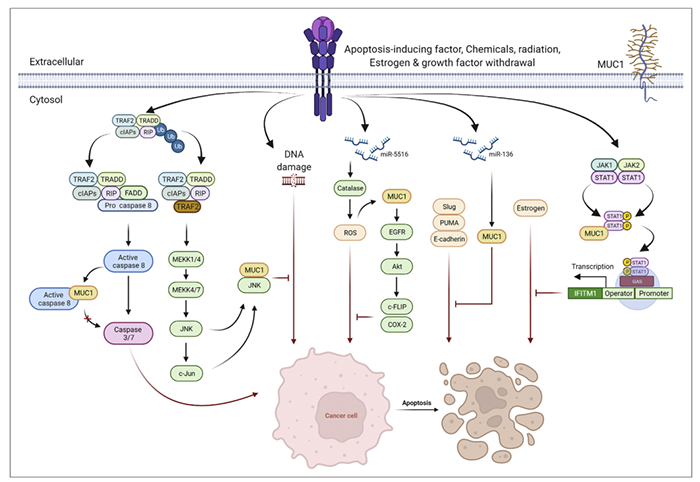
图4. MUC1抑制由凋亡物质、化疗药物和雌激素诱导的细胞凋亡
死亡受体超家族的激活诱导了caspase-8的激活,从而引发了一种凋亡反应。MUC1-CD通过直接与caspase-8 p18片段结合并阻止caspase-8募集到死亡诱导信号复合体来抑制细胞凋亡。在化疗药物应激条件下,miR-551b通过抑制过氧化氢酶的表达导致细胞内ROS积聚。累积的ROS促进MUC1的过度表达,而MUC1促进EGFR介导的涉及Akt/c-Flip/COX-2的细胞生存级联的激活并抑制细胞凋亡。此外,MUC1通过激活HCT116中的JNK1抑制顺铂诱导的细胞凋亡。MUC1和STAT1之间的相互作用通过JAK/STAT信号通路驱动IFITM1在芳香酶抑制剂耐药的乳腺癌细胞中过表达,并抑制雌激素诱导的细胞凋亡。
MUC1与肿瘤干细胞
肿瘤干细胞(CSCs)是肿瘤细胞中具有自我更新能力的一组细胞,被认为是致癌、促进肿瘤进展、肿瘤转移和癌症复发的原因。MUC1-C直接与MYC结合并驱动BRN2、Yamanaka OSKM(OCT4、SOX2、KLF4和MYC)多能因子的激活和神经内分泌(NE)去分化(图5)。
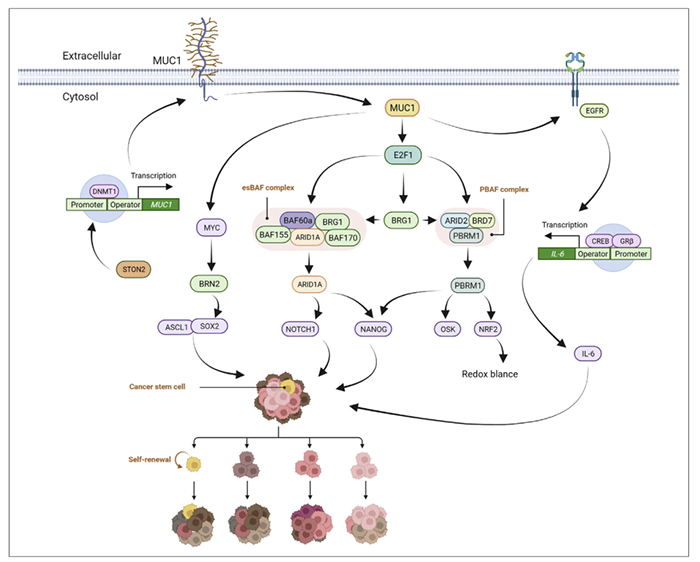
图5. MUC1与肿瘤干细胞
MUC1与DNA甲基化
MUC1和DNA甲基化过程之间有错综复杂的联系。一方面,MUC1可以调节基因甲基化。研究发现发现MUC1-C通过与DNMT1和DNMT3b启动子区域结合来调节DNA甲基化。此外,研究也发现MUC1降低了胃癌细胞中TFF2的甲基化,进而增加了TFF2的表达,并与预后相关。
MUC1与肿瘤耐药
研究发现,MUC1-CD不仅参与了多药耐药的形成,而且促进了多药耐药(MDR)基因的表达。沉默MUC1的癌细胞可使其对曲妥珠单抗、顺铂和tamoxifen敏感。
长期使用曲妥珠单抗会导致对曲妥珠单抗敏感的乳腺细胞中FN、EGF和IL-6上调,促进STAT3的过度激活,从而促进MUC1和MUC4的表达,并通过维持HER2的持续激活最终导致对曲妥珠单抗的抗药性。沉默MUC1-C通过下调HER2激活逆转乳腺癌细胞对曲妥珠单抗的耐药性。Namba等人使用KL-6/MUC1的单抗隔离MUC1,逆转了乳腺癌细胞对曲妥珠单抗介导的耐药性。
Keisuke Shigeta等人的研究发现,在顺铂耐药的尿路上皮细胞系中,MUC1-C高表达,并伴有PI3K-AKT-mTOR信号通路和MDR1表达上调。MUC1下调后,PI3K-AKT mTOR信号通路和MDR1水平均降低,对顺铂的敏感性显著提高。这表明MUC1-C通过PI3K-AKTmTOR信号通路激活MDR1,导致尿路上皮癌细胞耐药。
MUC1-C在Rab31的启动子上与ERa形成复合体,从而减少了tamoxifen对ERa的占据,最终导致对tamoxifen的耐药性。沉默MUC1-C导致pHER2下调,并恢复tamoxifen的敏感活性。
以MUC1为基础的抗肿瘤治疗
基于MUC1的治疗主要包括单抗、ADC、肿瘤疫苗、适配子,其中一些已经进入临床实验(图6)。
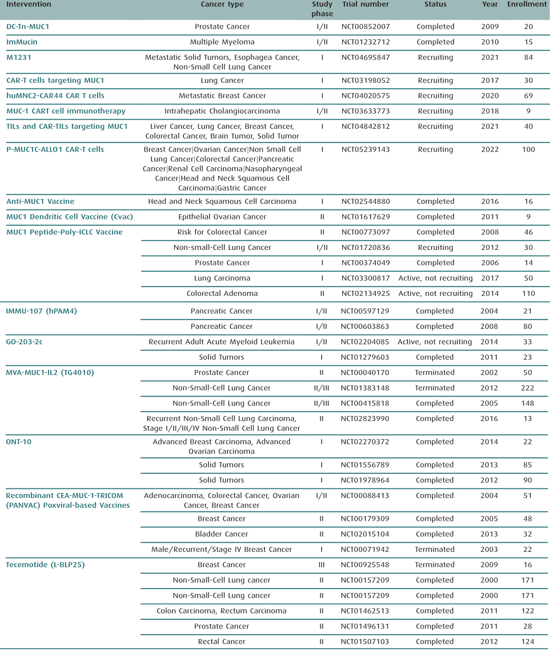
图6. 基于MUC1药物的临床试验
单抗
以往针对MUC1的单抗治疗主要针对MUC1-N,但在治疗肿瘤方面效果不佳。研究人员目前正在开发针对MUC1-C和MUC1糖基的下一代单抗。Kim等人通过噬菌体展示技术分离出针对MUC1-C的抗体。后续实验证实,SKM1-02、-13和-20抗体显著抑制TNBC细胞的侵袭,SKM1-02显著抑制细胞生长。
Naito等人以MUC1糖肽库为基础,设计合成了两种新型的MUC1单抗(1B2和12D10)。1B2和12D10都识别MUC1肽的PDT*R基序上的糖链。1B2识别GalNAc上O6位的O-糖链,而12D10识别相同位置的Neu5Ac。
ADC
基于MUC1的ADC的靶点包括MUC1蛋白骨架(MUC1-C、MUC1-N)和MUC1糖基相关蛋白。Wu等人开发了一种人源化MUC1抗体(HzMUC1),它只识别肿瘤细胞表面的MUC1。ADC由HzMUC1与MMAE偶联而成。HzMUC1 MMAE通过诱导G2/M细胞周期停滞和促进细胞凋亡来抑制曲妥珠单抗耐药和HER2阳性乳腺癌细胞生长。Panchamoorthy等人研制了基于MUC1-C的3D1-MMAE ADC药物,并在体外实验中验证了其对MUC1-C阳性肿瘤细胞的杀伤作用。
除了在MUC1蛋白骨架上发挥作用的ADC外,MUC1糖基化相关蛋白也是ADC的靶标。例如,SAR566658通过识别MUC相关的唾液酸糖蛋白CA6来诱导肿瘤细胞死亡,并且在动物肿瘤模型中观察到SAR566658的有效剂量与CA6的表达相关。GSTA是一种特异性糖基化新抗原肽,位于MUC1异常糖基化的串联重复序列区域。MUC1 ADC的通过将GSTA新抗原特异性16A抗体与MMAE偶联来诱导细胞杀伤。研究发现16A-MMAE以剂量依赖的方式抑制肿瘤生长,并且在表达人MUC1的转基因小鼠中不会产生显著的毒性。
适配子
适配子是具有高度特异性和亲和力的单链DNA、RNA寡核苷酸或具有三维结构的多肽。适配子可以与多种分子结合,包括纳米粒子、两亲性物质、药物等。Hanafi-Bojd开发了一种与二氧化硅纳米颗粒相结合的MUC1适配子,以有效地靶向乳腺癌细胞。Vivo-Llorca等人进一步表明,MUC1适配子包裹的二氧化硅纳米颗粒可以靶向Navitoclax耐药的TNBC细胞并诱导凋亡。
Tan L等人的研究以MUC1适配子(APT)为载体,将阿霉素(DOX)导入表达MUC1的乳腺癌细胞(MCF7)。研究发现与游离DOX相比,APT-DOX复合体在不降低对靶细胞的细胞毒性的情况下,将巨噬细胞的存活率提高了近6倍。
Khanet等人开发并验证了一种DNA适配子,它能特异性识别剪接变异体MUC1/Y,该剪接变异体在体内抑制乳腺癌细胞的生长。
肿瘤疫苗
与正常表型相比,恶性表型癌细胞的MUC1糖基化显著改变,肿瘤相关的O-糖链可作为肿瘤疫苗设计的靶点。
Bilusic等人研制的基于多靶点的Ad5PSA/MUC-1/Brachyury重组免疫治疗疫苗。对于转移性去势抵抗前列腺癌(MCRPC)的患者,已经完成了I期临床试验,该疫苗耐受性良好。
Wu等人开发了一种基于MUC1保护性抗原决定簇的Qβ-MUC1偶联疫苗,对乳腺癌细胞具有显著的选择性,克服了免疫耐受的缺陷。
Liu等人构建的纳米颗粒能够将MUC1 mRNA疫苗运送到淋巴结中的树突状细胞(DC),以激活和放大肿瘤特异性T细胞。mRNA疫苗联合CTLA-4单抗可显著增强机体免疫应答,有效抑制TNBC细胞生长。
MUC1是一种高度糖基化的I型跨膜蛋白,在上皮细胞的管腔表面形成一种保护性屏障。MUC1在肿瘤细胞中高表达,其可通过调节肿瘤细胞代谢、EMT、抑制肿瘤细胞凋亡等方面促进肿瘤进展、增强肿瘤耐药性。因此,MUC1可能成为未来肿瘤靶向治疗的新靶点。目前针对MUC1的疫苗、抗体、ADC适配子正在开发中,一些处于I/II期临床试验,并已经显示出显著的治疗效果。尽管取得了这些进展,MUC1的具体作用机制仍然有待进一步探索。














