铁死亡的标志物
铁死亡的标志物是寻找相关生理过程的必要工具。可分为几类:
检测脂质过氧化的标志物;
线粒体在铁死亡期间通常表现出萎缩、密集的形态。可以检测到特定的基因表达变化;
表达TfR1上调和向质膜移动。
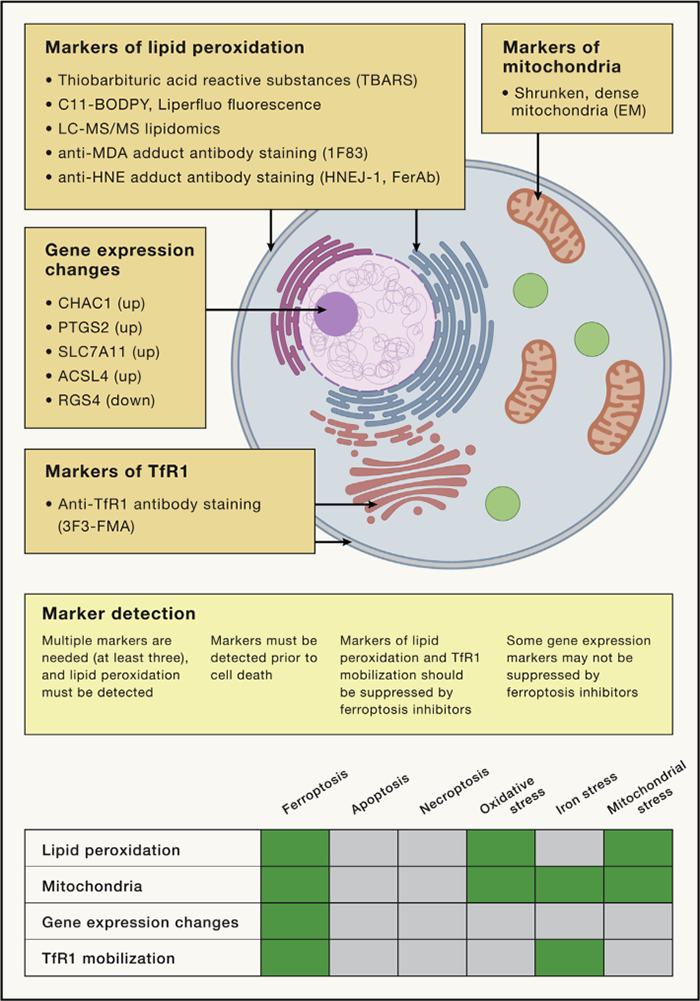
铁死亡标志物
Cell. 2022 Jul 7;185(14):2401-2421.
相对应的检测方式有:
检测脂质过氧化:
硫代巴比妥酸反应物质(TBARS)测定法;
通过LC-MS/MS直接检测异前列腺素或脂质过氧化产物;
C11-BODIPY荧光探针的氧化;
检测加合物的抗体的反应性,例如HNE FerAb抗体、HNEJ-1抗体 和抗丙二醛(MDA)加合物1F83抗体。
检测TfR1:TfR1的丰度和血浆定位增加是铁死亡的标志物。
可以用新发现的3F3-FMA抗体以及其他TfR1抗体检测。
机器学习可识别发生铁死亡的细胞和发生凋亡的细胞。
检测基因表达改变:CHAC1、PTGS2、SLC7A11和ACSL4等几个基因在铁死亡过程中被诱导,而RGS4在铁死亡过程中被下调;这些基因的表达改变可以通过qPCR检测。
不过,某些应激条件可以激活其中一些标志物而不激活铁死亡。因此,检测多个标志物对于明确识别铁死亡很重要。
涉及铁死亡的生理过程
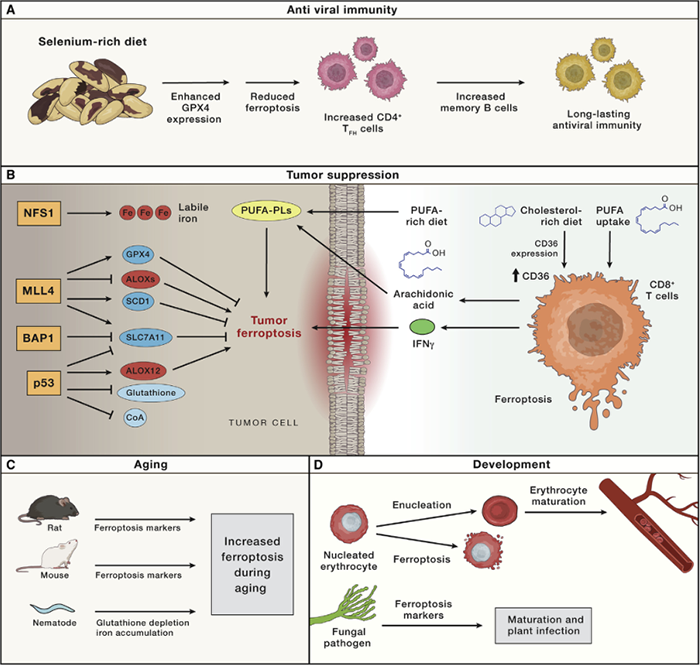
(1) 补硒可促进抗病毒免疫。
富硒饮食可增强硒蛋白GPX4的表达,从而抑制CD4+TFH细胞的铁死亡,进而促进记忆B细胞的增加和持久的病毒免疫。
通过补充硒增加GPX4丰度会增加接种流感疫苗后的抗体反应。
不过目前其他一些研究表明补充硒的益处有限。需要进一步验证硒和GPX4在TFH细胞亚群中的作用。
(2) 许多肿瘤抑制因子通过诱导铁死亡发挥其部分肿瘤抑制功能。
p53:
常见的突变肿瘤抑制蛋白p53可抑制溶质载体家族7成员11(SLC7A11)的表达。
p53还可在脂质过氧化的引发剂的存在下被诱导激活ALOX12依赖性的细胞死亡。
非洲裔人群中发现其密码子47(S47)上的p53变体能够改变p53诱导细胞死亡和抑制肿瘤形成的能力。同时带来GSH和CoA的积累,增加感染风险,但也增加了对疟疾的抵抗力。这一突变也多见于疟疾高感染地区。
MLL4:
皮肤鳞状细胞癌中通常会出现表观遗传调节因子MLL4的缺失,导致癌前皮肤病变发展。
小鼠模型中:MLL4缺失驱动了抑制铁死亡的转录变化,包括SLC7A11、GPX4、硬脂酰辅酶A去饱和酶1(SCD1)的表达增加,所有这些都导致了对铁死亡的抑制。
MLL4缺失同样促进脂氧合酶ALOX12、ALOX12B和ALOXE3等促进铁死亡的因素增加。
泛素羧基末端水解酶(BAP1)和NFS1:
具有类似MLL4的肿瘤抑制作用,调节铁死亡机制。
PUFA:
肿瘤细胞从细胞外环境摄取PUFA可抑制肿瘤生长。因此,富含PUFA的饮食可促进PUFA-PLs的产生,从而促进肿瘤铁死亡。已在异种移植小鼠模型中得到证实;
CD8+ T细胞:
肿瘤微环境中的胆固醇会导致CD8+ T细胞上CD36表达增加,并导致这些细胞摄取PUFA。因此,过量的胆固醇积累可通过消融 CD8+肿瘤浸润淋巴细胞来促进肿瘤形成。
活化CD8+细胞分泌的IFNγ能够通过下调SLC7A11导致肿瘤细胞铁死亡。
IFNγ还可上调ACSL4,有助于游离PUFA和PL结合。
CD8+T细胞来源的IFNγ和外源性特定PUFA可能是第一个确定的天然铁死亡触发因素。
(3) 铁死亡参与发育和老龄化。
抗体HNEJ-1可识别用脂质过氧化的终产物4-羟基-2-壬烯醛(HNE)修饰的蛋白质,并证明它可识别铁死亡细胞。
铁死亡可能与红细胞生成的正常过程以及许多器官的衰老有关。抑制铁死亡也导致红细胞去核延迟。
其他物种:例如秀丽隐杆线虫的衰老与铁水平升高、谷胱甘肽耗竭和对铁死亡的敏感性增加有关。
例如遗传性血色病就是由铁调节基因的遗传突变引起的。 在遗传性血色素沉着症模型小鼠中,低铁饮食能逆转铁死亡的标志物。 喂食高铁饮食的小鼠和具有与遗传性血色病的小鼠会出现具有铁死亡标志物的肝损伤。可通过ferrostatin-1抑制铁死亡来逆转。 脑外伤也与铁过载有关。大鼠模型中将FeCl3注射到体感皮层可导致癫痫发作和认知功能降低。
多种模型显示在器官损伤期间铁死亡被激活。 5μm微塑料可诱导小鼠肝脏中铁死亡标志物出现。 PM2.5可诱导小鼠肺铁死亡。 铁死亡会导致肾脏修复缺陷和炎性近端肾小管细胞的形成。 血红素渗漏到器官可能是病理性引发铁死亡的常见机制。镰状细胞病模型小鼠的血清血红素、铁死亡标志物和心肌病标志物升高,而铁死亡抑制可减轻这些标志物的作用。 抑制铁死亡可能是预防重症监护环境中多器官损伤的可行策略。MODS患者血浆中脂质过氧化标志物与其SOFA评分呈正相关。 非酒精性脂肪性肝炎(NASH)小鼠模型中,铁死亡抑制剂罗格列酮与铁螯合剂去铁酮 (DFP) 联合治疗可抑制炎症细胞因子的基因表达和肝脏中的炎症细胞浸润。
在ALS患者和小鼠模型的死后脊髓中,GPX4被耗尽; G93A SOD1模型显示,GPX4过表达可延长生存期并延缓疾病发作。 Glu 毒性可能涉及铁死亡。不过其表现出的铁死亡机制可能与岁蟾酥等其他细胞死亡模式重叠。
丙肝病毒的复制受到宿主细胞中铁死亡的激活。去饱和程度更高的多不饱和脂肪酸通过脂肪酸去饱和酶2(FADS2)对过氧化的敏感性促进铁死亡。 COVID-19患者血清铁蛋白水平较高,表明组织中铁暴露量较高。小鼠模型中显示脂质变化和标志物TfR1诱导。 铜绿假单胞菌分泌脂氧合酶(pLoxA)在宿主肺中诱导铁死亡,与铜绿假单胞菌感染患者的较差临床结果相关。
系统性红斑狼疮(SLE)与中性粒细胞中的铁死亡激活有关。SLE患者血清通过由CaMKIV-CREMα介导的GPX4下调驱动的铁死亡促进中性粒细胞死亡。 哮喘恶化与由15-脂氧合酶驱动的人气道上皮细胞铁死亡、线粒体DNA的释放有关。 类风湿性关节炎炎性微环境中的成纤维细胞,TNF保护它们免于铁死亡,而IL-6使它们对铁死亡敏感。
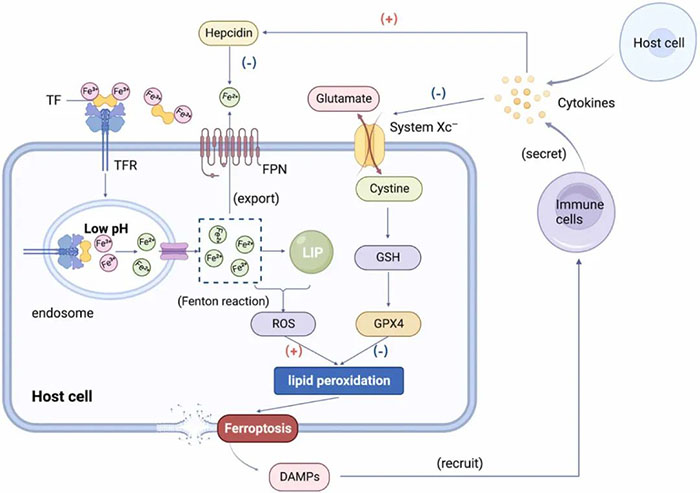
在炎症微环境中,微生物入侵也会干扰宿主细胞的铁代谢。 在损伤或感染引起的急性炎症反应中,机体通过急性期反应提高抵抗微生物入侵的能力,而铁调素是急性期蛋白之一。 宿主细胞通过分泌炎症介质相互作用,调节铁调素的表达,导致铁代谢发生变化。铁调素是体内铁代谢系统调节的关键因子,通过负调控其受体铁转运蛋白(FPN)来调节细胞内铁的输出。
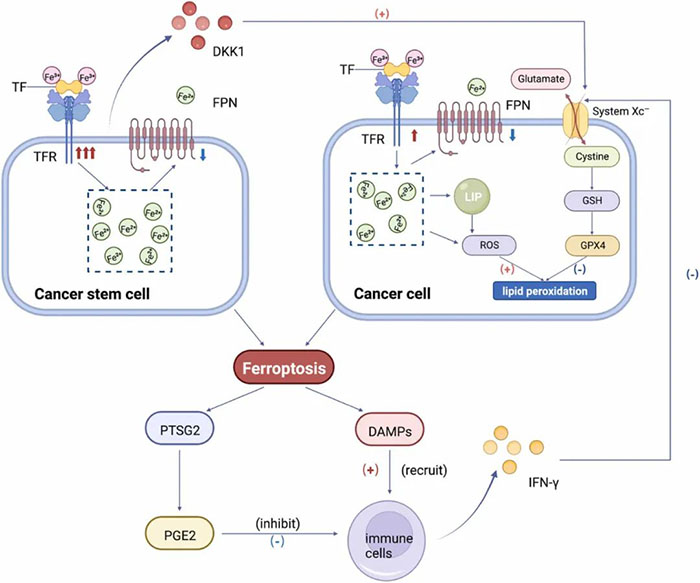
硒蛋白是癌症风险的预测因子,且在肿瘤组织中表达水平升高,表明GPX4在肿瘤发生中的丰度和活性升高。因此,在某些情况下,使铁死亡失活的遗传和环境扰动可能会驱动肿瘤发生。 淋巴环境会转移保护侵袭性黑色素瘤细胞免于铁死亡,从而增加转移扩散。这可能是由于淋巴液中高水平的油酸所致。
系统xc-抑制; GPX4 抑制/降解/失活; 还原型CoQ10消耗; 过氧化物、铁或PUFA过量诱导脂质过氧化。
弥漫性大B细胞淋巴瘤异种移植物对系统xc-抑制剂咪唑酮erastin的治疗很敏感。 敲除SLC7A11在小鼠胰腺癌遗传模型中提供了显着的益处,而不会诱导除铁死亡以外的其他类型细胞死亡的标志物。 胰腺癌细胞依赖于天冬氨酸氨基转氨酶GOT1,敲低可使铁死亡敏感。 肺肿瘤依赖NRF2抑制铁死亡以生存。 辐射可以诱导铁死亡,铁死亡诱导剂可以作为放射增敏剂。 诱导细胞凋亡的靶向药物的抗性与对铁死亡的敏感性增加有关。
阻断脂质过氧化过程; 通过脂质生物合成和 ACSL4 的作用产生用于过氧化的底物脂质; 控制铁的可及性; 间接手段:通过补硒上调GPX4。
室性早发性白质软化症、肾损伤和肝损伤模型:ferrostatin-1和liproxstatin作为自由基捕获剂可抑制脂质过氧化传播。 Glu毒性模型:降胆固醇药物普罗布考及其类似物可抑制铁死亡。 脑卒中:硒输送可抑制卒中期间的铁死亡。 创伤性脑损伤和HD模型:线粒体靶向氮氧化物XJB-5-131通过抑制细胞凋亡和铁死亡进行有效治疗。
饮食控制
膳食多不饱和脂肪酸促进秀丽隐杆线虫的铁死亡。 膳食维生素E抑制GPX4失活带来的影响。
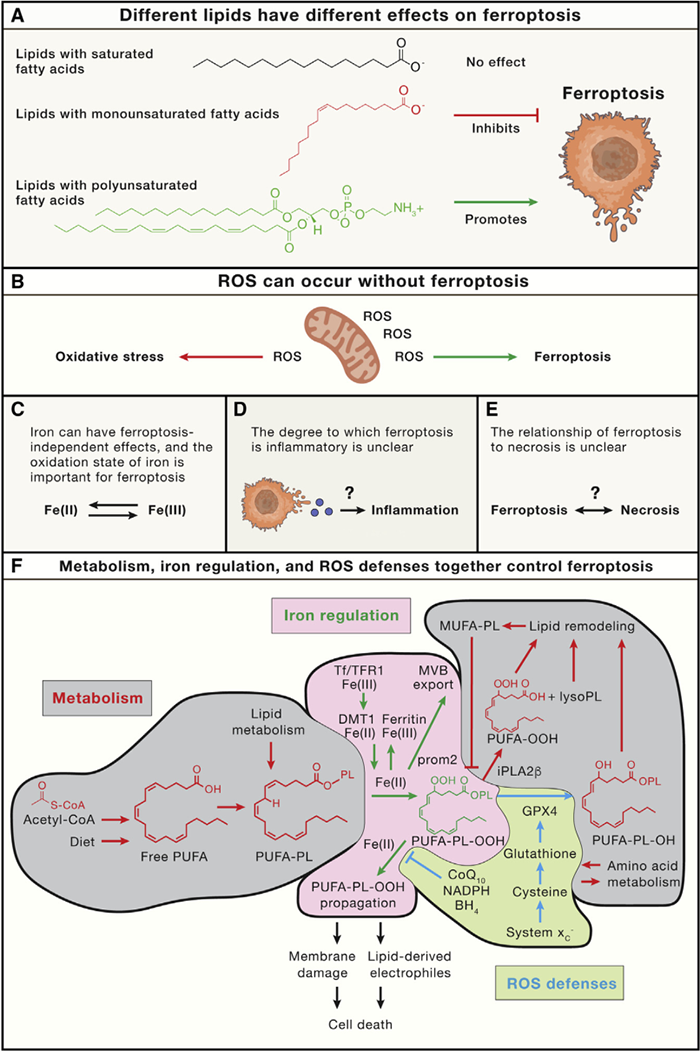
铁死亡机制小结
Cell. 2022 Jul 7;185(14):2401-2421.
铁死亡的执行机制,如细胞死亡的具体方式、地点和时间。 进一步定义铁死亡的全部启动机制及其使用环境。 如何选择性控制铁死亡机制以发挥治疗作用。














