CAR-T在细胞治疗领域备受瞩目,通过将嵌合抗原受体(CAR)导入T细胞,极大地改善了临床对肿瘤的治疗效果。
CAR-T的大获成功的同时也加速了CAR-Treg向临床转化的进展。
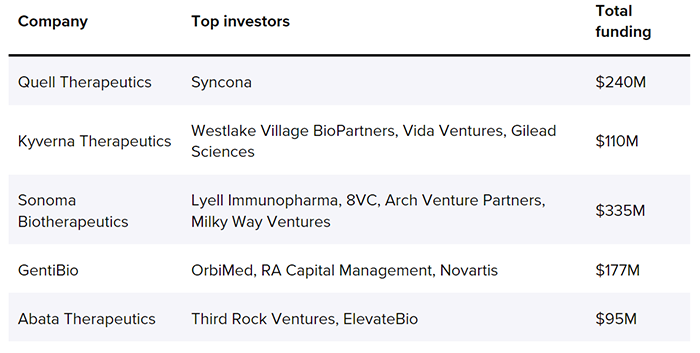
通过CAR技术,CAR-Treg能够绕过MHC限制性和提高治疗靶向性,在自身免疫性疾病及抑制物抗宿主病(GVHD)中表现出很好的治疗潜力,目前已有多家公司参与开发。
然而,尽管CAR-T对肿瘤疗效非常好,但由于生产成本极高,所产生的昂贵治疗费用让普通患者只能望而止步,CAR-Treg自然绕不开这个难题。
人们一直在积极寻找CAR-T工艺优化手段,以期改进疗效的同时减少生产成本,进而推动其市场化进程。
同样,CAR-Treg的生产也大致可以分为以下步骤:
获取细胞,分选富集 → 活化 → 基因传递 → 扩增 → 质检、储存、运输、回输
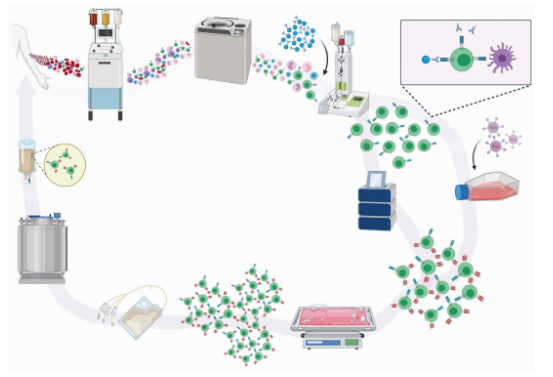
1. 采集,分选富集:
CAR-Treg以单采和来自外周血单核细胞(PBMC)为原料,主要也是通过磁珠细胞分选(MACS),获得维持免疫耐受的主要亚群:CD4+CD25highFoxp3+Treg。
目前CAR技术细胞来源均为自体细胞,Treg细胞占外周血CD4+T细胞的5-10%,部分疾病患者Treg含量更低,甚至在之后表现出无法扩增。
原材料无法标准化,细胞活力不可控,以及最主要的个性化定制均为造价昂贵的原因,因此细胞健康人的Treg细胞捐献是未来趋势。 以及通过CAR-Foxp3共载体转染可以将CD4或CD3T细胞转化为Treg,这也可以解决外周Treg细胞数量少和内源性TregFoxp3表达不足的。
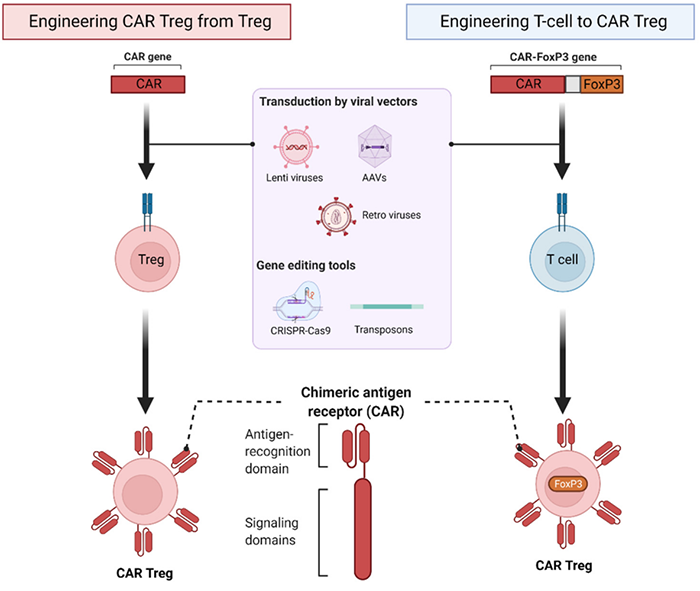
Biomedicines. 2022 Jan 26;10(2):287.
2. 基因导入:
通过慢病毒转染,将CAR基因传递到Treg细胞中是目前最主要基因导入方式。
该方法两个词总结:高效,昂贵。
病毒载体生产耗时耗力,并且有引起炎症反应和基因插入的致癌风险。
电穿孔技术是应用广泛的非病毒转染策略之一 通过短的脉冲使细胞产生短暂通透性,允许目的基因DNA或mRNA进入。但是这种方法容易引起细胞应激。 "sleeping beauty"转座子系统(SB) 将CAR转基因插入转座子序列中,再将相应质粒和转座子酶(hsSB)一同导入细胞,hsSB会将序列切下来整合到T细胞基因组,该技术整合效率接近病毒。
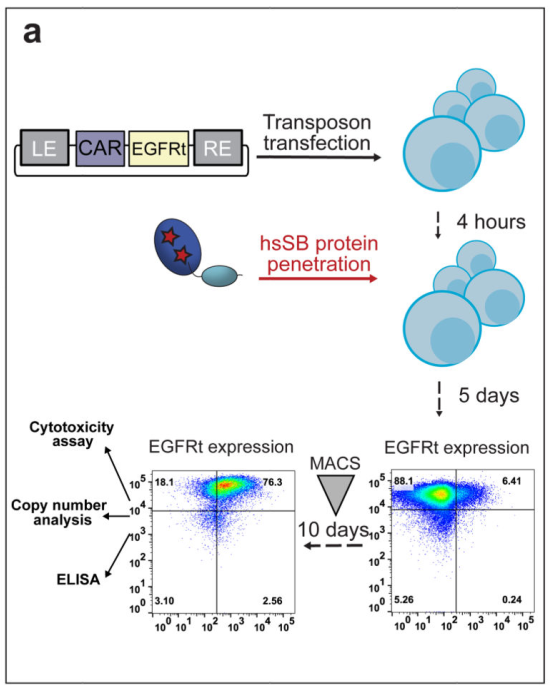
而且相较于病毒载体,SB系统在转染后质粒水平逐渐降低。而且质粒相对容易设计,在基因破坏方面也有很高的安全性。
原料Treg获取量非常少,所需达到治疗标准的CAR-Treg量非常大,而且考虑储存运输过程的消耗,相较治疗量产品药甚至需要近100倍的数量。
扩增所需培养基中必须加入胎牛血清或人血清,使用无血清培养基不但能够节省成本,并能降低外源物的污染。
扩增过程包含多种需人工变异操作,需要考虑多种外接因素的影响。
(如温度、湿度、气体张力、无菌性等)
作为未来各行业的发展趋势,人工智能(半)自动化及封闭性系统在保证操作精细度的同时能确保环境参数稳定,在提高产量的同时大大降低批次间差异。
5. 质量检测:
用于CAR-Treg的QC检测标准化尚且未制定。
常通过流式细胞术对CD4+CD25highFoxp3+Treg进行验证,并辅以Foxp3启动子区域的甲基化分析。
常规观察Treg对Tconv的抑制作用非常耗时,而且对体内的预测价值不大。
Foxp3对Treg在治疗过程维持表型而不会向Teff转化至关重要,添加雷帕霉素能够通过抑制mTOR通路维持Treg稳定性。或者基于CRISPR/Cas9的表观遗传编辑也可能是维持Treg表型的手段。
https://www.biopharmadive.com/news/treg-cell-therapy-biotech-startups/629634/
Fritsche E et al. Toward an Optimized Process for Clinical Manufacturing of CAR-Treg Cell Therapy. Trends Biotechnol. 2020 Oct;38(10):1099-1112.
Abou-El-Enein M et al. Scalable Manufacturing of CAR T cells for Cancer Immunotherapy. Blood Cancer Discov. 2021 Sep;2(5):408-422.
Arjomandnejad M et al. CAR-T Regulatory (CAR-Treg) Cells: Engineering and Applications. Biomedicines. 2022 Jan 26;10(2):287.
Querques I et al. A highly soluble Sleeping Beauty transposase improves control of gene insertion. Nat Biotechnol. 2019 Dec;37(12):1502-1512.
Diaconu I et al. Inducible Caspase-9 Selectively Modulates the Toxicities of CD19-Specific Chimeric Antigen Receptor-Modified T Cells. Mol Ther. 2017 Mar 1;25(3):580-592.














