铁死亡这种独特的细胞死亡程序由依赖铁的磷脂过氧化驱动,并受多种细胞代谢途径(包括氧化还原稳态、铁代谢、线粒体活性、氨基酸、脂质和糖代谢)和各种与疾病相关的信号途径的调节。
铁死亡信号通路中关键基因研究简史
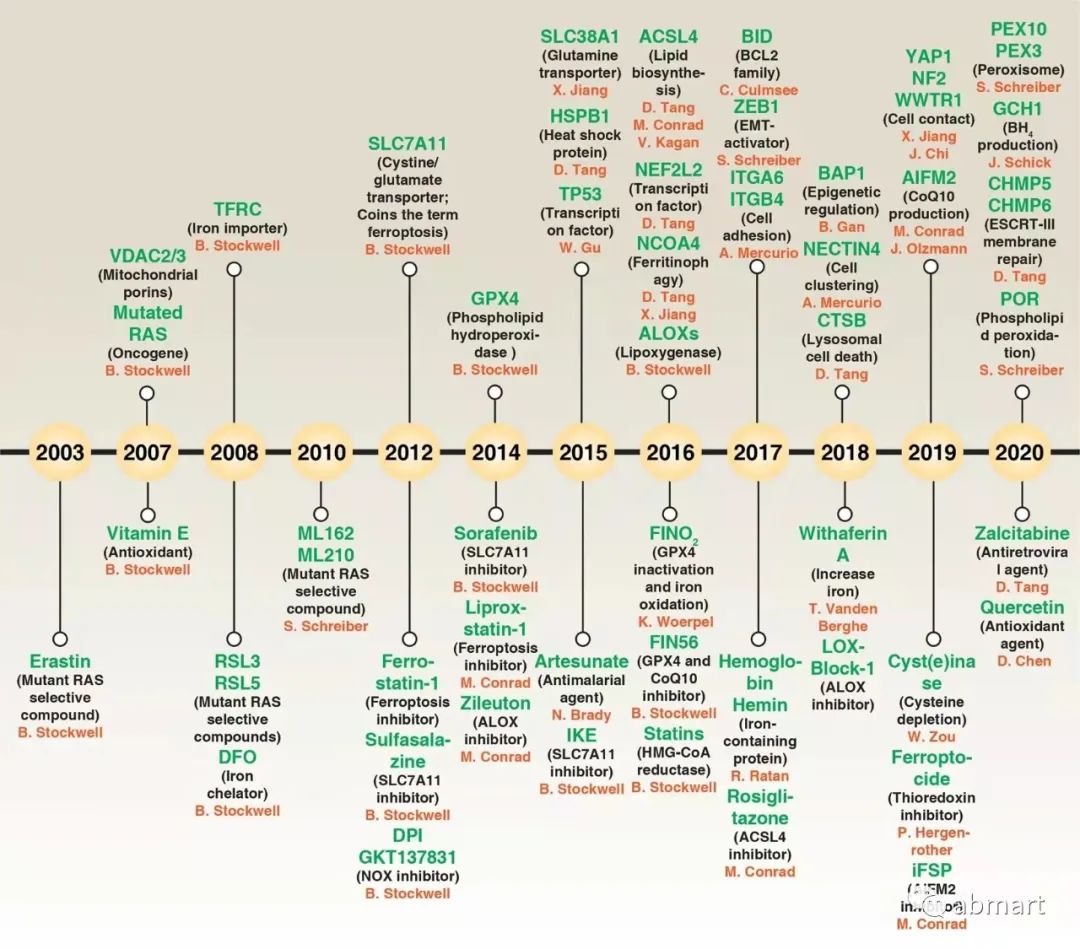
图片来源:Cell Research volume 31, pages107–125 (2021)
想必很多同学在研究铁死亡的过程中遇到了各种各样的疑难杂症,小编针对近几年发表的几篇高分综述文章进行了一个汇总:
1. 铁死亡的机制和特征有哪些?
早期研究表明,X-c-系统-GSH-GPX4的铁死亡途径受到抑制,而过氧化磷脂(PLOOHs)是一种基于活性氧(ROS)形式的脂质,是铁死亡被抑制的关键。已经发现了依赖GPX4的铁死亡监测途径,GPX4-RSL3的失活直接诱导铁死亡,而erastin抑制胱氨酸的转移使细胞失去半胱氨酸,而半胱氨酸是GSH的基本细胞成分,间接诱导铁死亡。最新研究表明,转铁蛋白受体(TfR)的动员和上调是铁死亡的另一个潜在标志,它可以区分氧化应激和铁死亡。
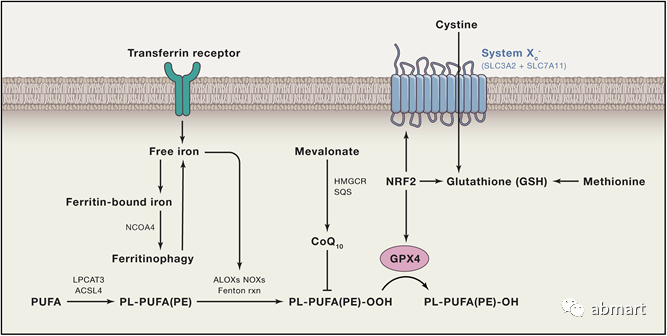
图片来源:Cell, 2017, 171 (2) 273-285.
铁死亡的特征包括:1. 形态学特征:细胞膜断裂和出泡,线粒体萎缩、线粒体脊减少甚至消失、膜密度增加、细胞核形态正常,但缺乏染色质凝集;电镜下观察到胞内线粒体变小、膜密度增高。2. 生物学特征:活性氧、铁离子聚集,激活丝裂原活化蛋白激酶(MAPK)系统,胱氨酸摄取减少、谷胱甘肽耗竭,抑制ystemXc-;基因水平:主要受到核糖体L8(RPL8)、铁反应元件结合蛋白(IREB2),ATP合成酶F0复合体亚基C3(ATP5G3)、三四肽重复结构域35(TTC35)、柠檬酸合成酶(CS)、酰基辅酶A合成酶家族成员2(ACSF2)以及受代谢、储存基因TFRC、ISCU、FTH1、FTL、SLC11A2的调节。
2. 参与铁死亡的三大系统
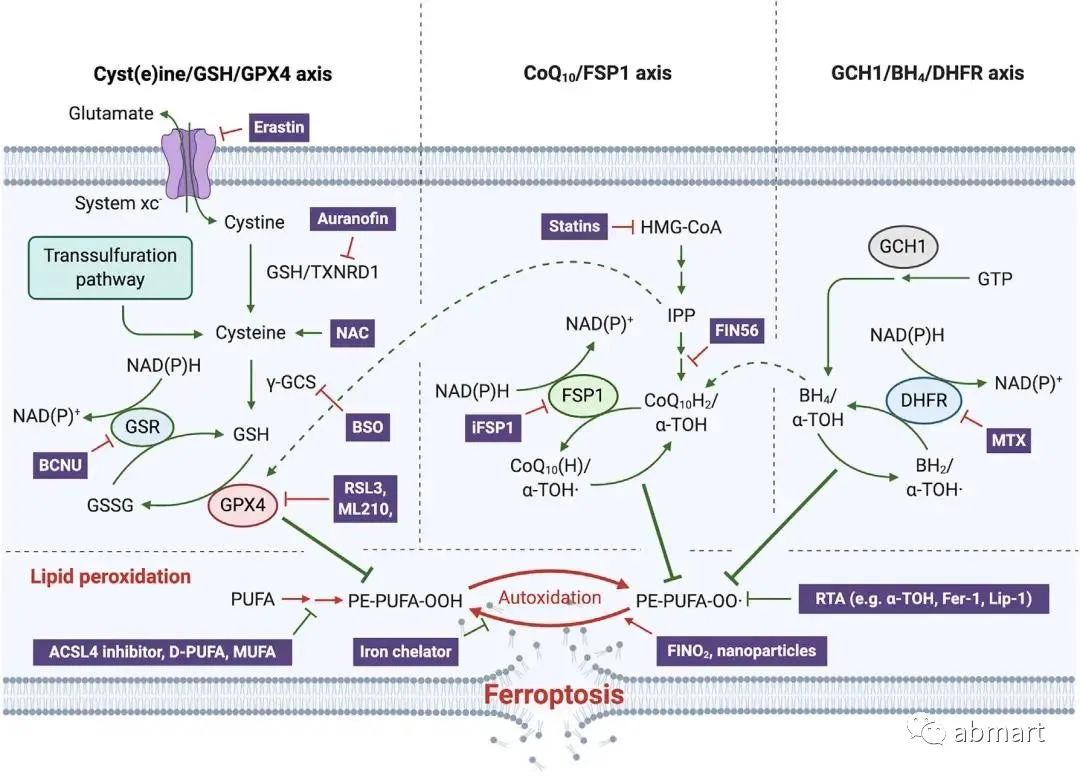
图片来源:Cell Metab. 2020 Dec 1;32(6):920-937.
2.1 X-c-系统-GSH-GPX4
X-c-系统(含有SLC7A11和SLC3A2亚单位的跨膜蛋白复合物,以下简称为X-c-系统)-GSH-GPX4的铁死亡途径受到抑制,而过氧化磷脂(PLOOHs)是一种基于活性氧(ROS)形式的脂质,是铁死亡被抑制的关键。GPX4是PLOOH的主要中和酶,其主流机制是erastin/RSL3诱导铁死亡。谷胱甘肽通路已被鉴定为关键的抗氧化防御通路。该过程的核心作用是代谢蛋白谷胱甘肽过氧化物酶 4 (GPX4),其将 GSH 转化为氧化谷胱甘肽(GSSH),从而通过限制细胞毒性脂质过氧化来保护细胞免受铁沉积。谷胱甘肽过氧化物酶通路进一步受系统 Xc- 调节,该系统是一种氨基酸反转运体,由 xCT/SLC7A11 的异二聚体和 SLC3A2(4F2hc/CD98) 组成,对谷胱甘肽 (GSH) 合成至关重要。重要的是,诱导铁死亡的一种方法是使用直接抑制系统 Xc- 功能的化合物蛋白。涉及氧化应激的基因(包括 GPX4)的调节在很大程度上受转录因子 NRF2 的控制。这是防止铁死亡的关键防御措施。在正常条件下,NRF2 的表达通过与 KEAP1(泛素 E3 连接酶复合物的一部分,导致 NRF2 蛋白酶体降解)相互作用而受到抑制。氧化应激导致 KEAP1 的构象变化,破坏这种相互作用,从而导致 NRF2 的稳定。该过程通过自噬通路得到进一步调节,其中自噬货物受体 p62/SQSTM1 可以竞争性抑制 KEAP1-NRF2 复合物,从而导致 NRF2 上调。
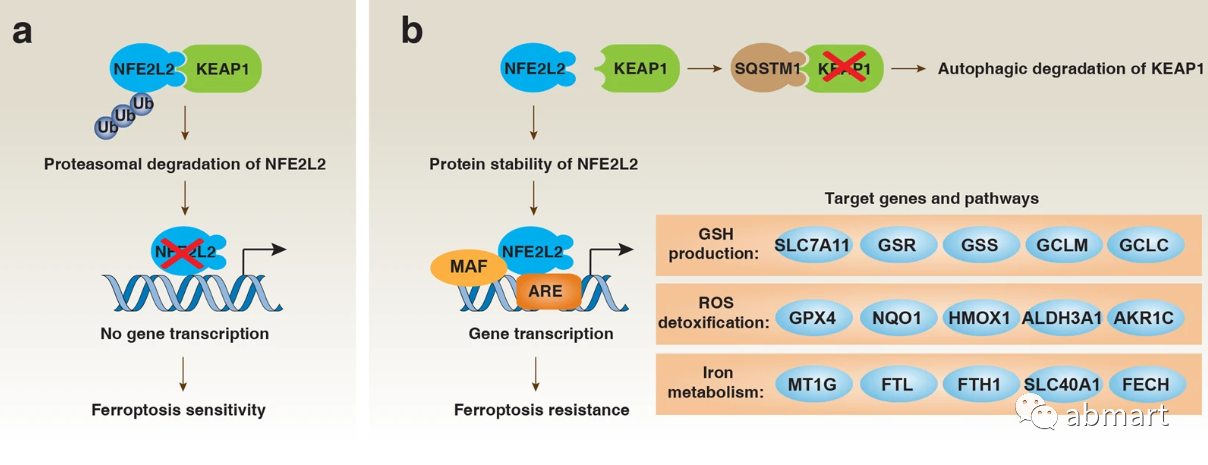
图片来源:Cell Research volume 31, pages107–125 (2021)
2.2 NAD(P)H/FSP1 /CoQ10系统
FSP1与GPX4同样具有潜在的“NADH氧化酶功能”的未知基因所编码的蛋白可抑制细胞死亡。FSP1属于II型NADH:醌氧化还原酶NDH-2家族,是传统线粒体呼吸系统的一个分支,催化与复合体I同样的反应,只是不泵送质子。FSP1主要定位于脂滴和质膜,是一种清除有害脂质过氧化物的系统。从机制上讲,线粒体外泛醌被FSP1从CoQ10还原而来,既可直接捕获脂质自由基,也可以通过回收α-生育酚来间接充当抗氧化的角色
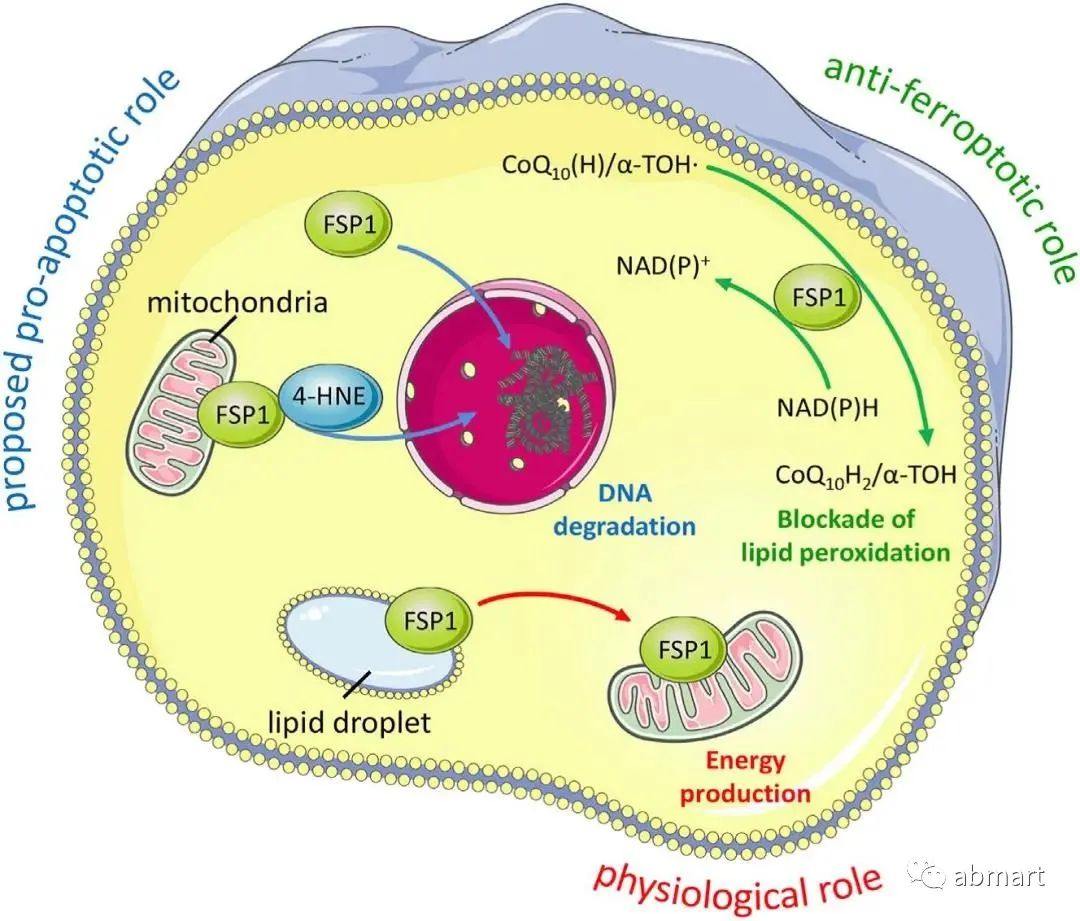
2.3 GCH1/BH4/DHFR系统
近期一项研究通过CRISPR全基因组筛选并确定了一种不依赖于GPX4的铁死亡抑制基因,即鸟苷三磷酸环水解酶GCH1(四氢生物蝶呤BH4合成的限速酶)。如果阻断二氢叶酸还原酶DHFR,可协同GPX4抑制剂发挥诱导铁死亡的作用。此外,BH4还可以通过将苯丙氨酸转化为酪氨酸来促进CoQ10的合成,从而发挥抗氧化作用。
3、铁转运蛋白与铁 “超载”
有研究证明,细胞内的铁离子水平,在细胞铁死亡期间会明显增加。铁超载是铁死亡过程的必要条件,而各种铁螯合剂均能抑制细胞的铁死亡。铁超载会促进脂质过氧化和活性氧(ROS)的聚集,诱导铁死亡。
转铁蛋白 (血清转铁蛋白或乳铁蛋白) 通过转铁蛋白受体 (TFRC) 介导铁摄取,FTH1/FTL (铁蛋白组件) 通过自噬降解可以增加铁的水平,这些都可以促进铁死亡。而 SLC40A1 介导的铁外流和外泌体介导的铁蛋白输出会抑制铁死亡。铁蛋白水平可以通过靶向铁蛋白的选择性自噬过程进行调节,称为铁蛋白自噬。该通路由铁蛋白的选择性货物受体介导,称为核受体辅激活因子 4 (NCOA4)。已证明使用一些常见的铁螯合剂(例如去铁胺)可以抑制铁死亡。
铁死亡过程中的核心调控分子和信号通路
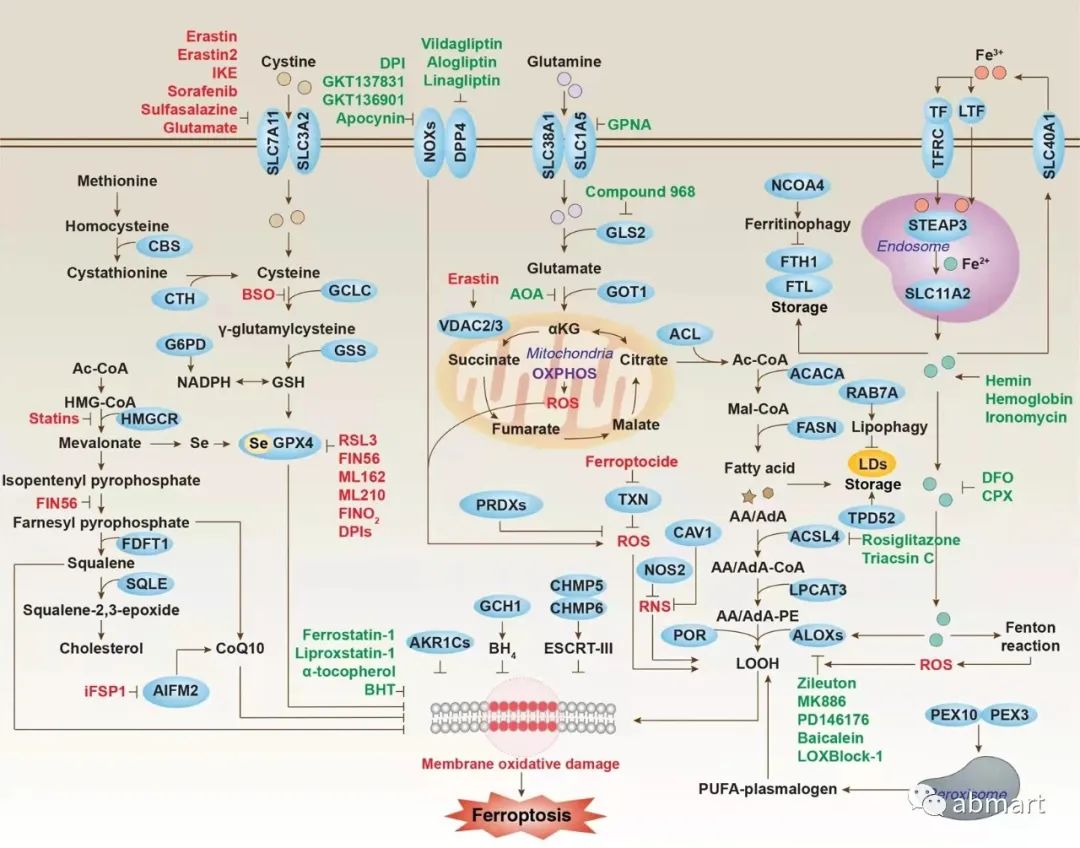
图片来源:Cell Research volume 31, pages107–125 (2021)
最后,总结一下最近一篇高分综述文章中关于铁死亡的3个观点:
1、铁死亡 (Ferroptosis) 是一种调节性的细胞死亡,依赖于铁介导的氧化损伤。
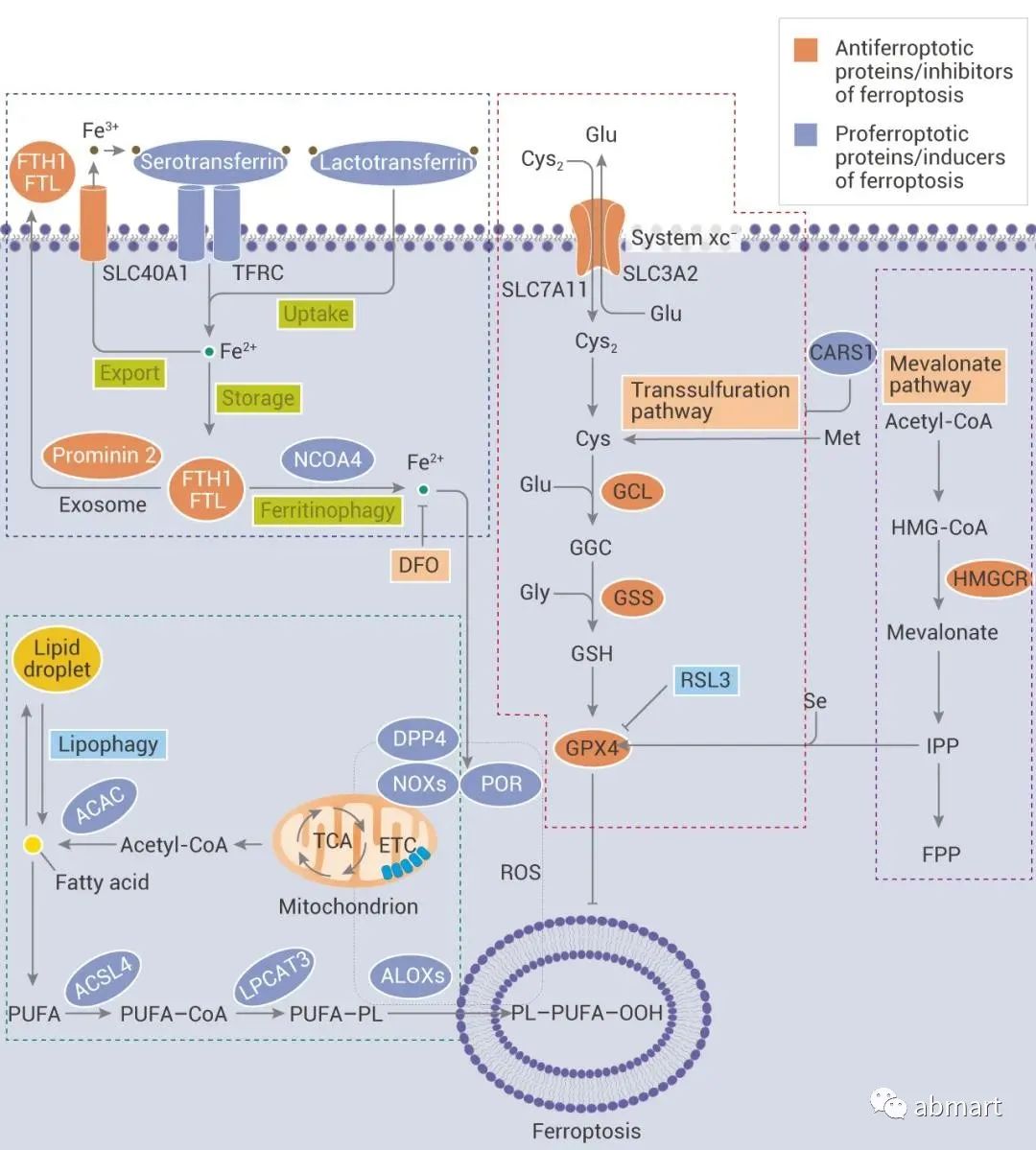
(红色框:GSH-GPX4 抗氧化系统在铁死亡途径中起重要作用;蓝色框:铁积累与铁死亡;绿色框:脂肪酸积累与铁死亡调控;紫色框:甲羟戊酸 (MVA) 途径抑制 GPX4 的合成。)
图片来源:Nat Rev Clin Oncol. 2021 May;18(5):280-296.
总结了这么多篇综述文章,具体铁死亡研究需要检测哪些指标呢?
铁含量的检测
铁离子的变化是铁死亡的关键,两者成正相关。检测铁离子的含量,能够评价铁死亡是否发生。因此,可通过铁测试盒检测细胞或组织内铁的含量,从而推出结果。
铁水平检测:可以使用PGSK探针,流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料;或者使用Iron Assay Kit检测细胞、组织中的铁水平;
活性氧水平检测
细胞活性氧水平与铁死亡发生正相关,细胞内ROS测定广泛用于铁死亡的研究。
脂质过氧化物检测
脂质过氧化物含量增加是铁死亡发生的重要标志。因此,对MDA ,LPO,TBARS,这些脂质过氧化物含量的检测,在铁死亡研究中已经普遍存在。细胞内活性氧和脂质活性氧通过流式细胞术使用DCFH-DA和C11-BODIPY 荧光探针检测;
抗氧化能力的检测
抗氧化能力下降会促进铁死亡的发生。例如,GSH是机体重要的抗氧化剂,减少GSH含量会促进铁死亡的发生。所以通过检测细胞GSH含量的变化,有利于铁死亡的评价。
检测与铁死亡相关的蛋白表达,如PTGS2(COX2)、NOX1、FTH1、GPX4、Xct/SLC7A11、NRF2、ACSL4等,其中PTGS2(COX2)、ACSL4、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调;
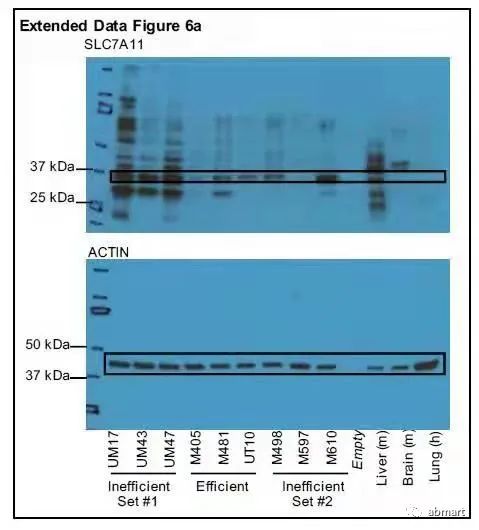
注:几个靶点WB检测的常见问题汇总
1. Xct/SLC7A11:只有CST家的抗体检测位置在37kd,其他厂商抗体均检测在55kd。该蛋白理论分子量应该也是55kd。
CST家的抗体在Nature中使用的数据如下:
2. NRF2这个蛋白,在入核的时候会发生修饰,导致蛋白分子量为100kd左右。没有入核的时候,蛋白分子量为70kd左右。且未入核形式的NRF2容易发生泛素化而被降解清除。
(具体推荐抗体产品见下)
形态学检测
超微结构显示,铁死亡时细胞膜断裂和出泡,线粒体萎缩、线粒体脊减少甚至消失、膜密度增加、细胞核形态正常,但缺乏染色质凝集;电镜下观察到胞内线粒体变小、膜密度增高。线粒体观察:向细胞内转染LifeAct-GFP荧光蛋白,一段时间后用有丝分裂追踪器观察线粒体形态。
细胞活性检测
铁死亡是一种细胞死亡方式,细胞数量减少,可通过CCK-8和LDH细胞毒性检测细胞活性。
铁死亡抑制剂:
多种药物抑制剂已被证明可诱导铁死亡,如细胞外高浓度的谷氨酸Glu或小分子抑制剂包括Erastin、柳氮磺胺吡啶、索拉非尼。抑制铁死亡的化合物包括a-toc(a-tocopherol,维生素E)、艾地苯醌idebenone、Fer-1、Lip1和去铁胺(deferoxamine,DFO)。
来源:abmart














