传统抗体分子量约150KD,大小尺寸为14.2 nm × 8.2 nm × 3.8 nm,使其实体瘤的穿透性差,实体瘤的疗效不理想。来自于驼类和鲨鱼的纳米抗体(重链可变区VHH),分子量约为传统抗体的十分之一,让人们看到了实体瘤治疗的希望。本文总结纳米抗体的八个优势,以及在肿瘤诊断临床中的六个应用。
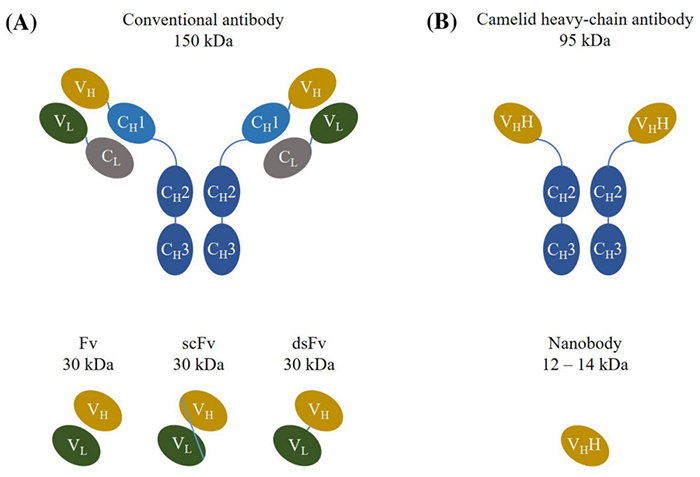
分子1量小。12-14KD的分子量,约为传统抗体的十分之一。
1.免疫原性低。纳米抗体和人IgG 重链的序列80%以上一致,且分子量小,故免疫原性弱,较少产生抗药物抗体。有助于避免重复用药的耐药问题。
2.稳定性高。
3.降解抗性高。耐受温度、压力和pH的变化,易于储存、运输。
4.原核生物表达。
5.大规模生产成本低。
6.组织穿透性好,适合实体瘤的影像诊断和治疗。
7.产品表征容易。结构简单,翻译后修饰低,均一性好。
分子影像
癌症可以通过单光子发射计算机断层扫描(SPECT)、正电子发射断层扫描(PET)、计算机断层扫描(CT)、超声和光学成像进行可视化诊断。
抗体和纳米抗体与放射性核素、正电子发射放射同位素和近红外荧光团相连。放射性核素(99mTc、177Lu、123I等)用于SPECT成像,而正电子发射放射性同位素(68Ga、124I、89Zr、 18F等)用于PET成像。
因为纳米抗体分子量小,组织穿透性好,所以成像时间快(1-3小时),体内清除也快,肿瘤/背景比更高,是比传统单抗更好的成像抗体。

分子影像广泛应用于:靶点分布、抗体药物体内分布、肿瘤诊断等领域。
肿瘤诊断
将治疗性化合物与诊断性放射性示踪剂结合,并进行诊断扫描,可以可视化该化合物在癌细胞中的积累。放射性标记的纳米抗体可以用于识别特定的肿瘤相关生物标志物,从而帮助癌症诊断和确定适当的治疗方法。
纳米抗体迅速扩散到组织中,并特异性地在靶组织中积累(在非靶组织中积累最小),这导致快速产生高对比度图像,从而允许对患者进行早期诊断。放射性标记的纳米抗体可用于全身扫描,以检测原发性肿瘤和转移性病变分布(如下图)。
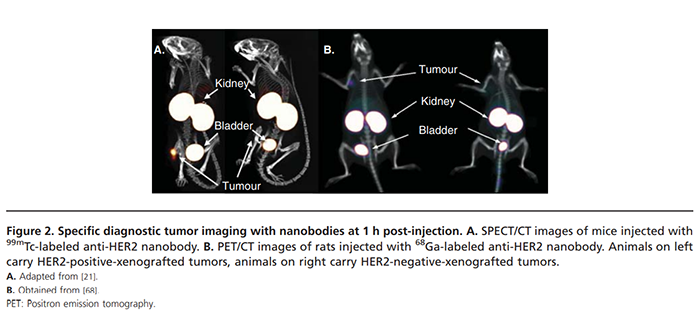
诊断扫描有助于估计剂量、监测治疗反应、评估治疗效率和预测治疗的不良反应。
成像引导手术
绝大部分肿瘤需要手术治疗,到2030年,全球一年可能需要4500万台手术。预防性手术的目的是去除易致癌的组织,损伤更小、费用更低、将恶性病变降到最低,而诊断技术对于确定适当的治疗和管理癌症很重要。
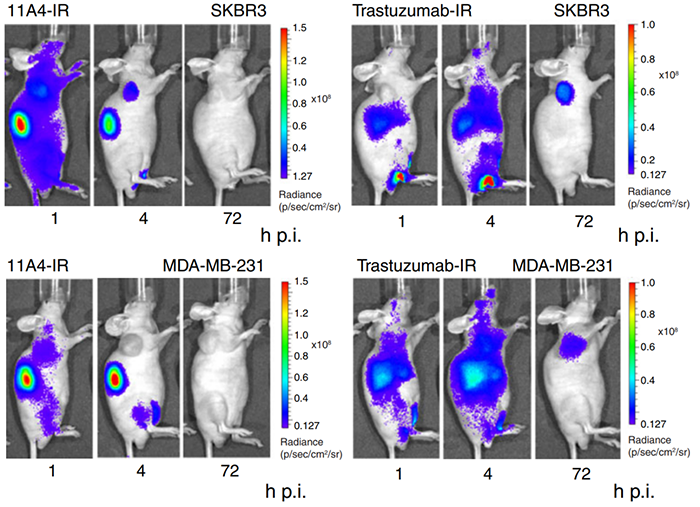
纳米抗体在手术中的一个很有前途的应用是成像引导下的手术。小鼠人类异种移植乳腺癌模型,将抗HER-2Nb(11A4)与IRDye800CW结合,与曲妥珠单抗-IRDye800CW相比,11A4-IRDye800CW增加了肿瘤积累和肿瘤与背景的比值(下图,文献3)。并且基于图像引导手术切除小鼠SKBR3肿瘤。
靶向放射治疗
放射治疗依旧是肿瘤最具性价比的治疗手段之一,大约50%的癌症患者接受放射治疗。
放射治疗的目的是将恶性细胞暴露于最大的辐射剂量下,同时正常细胞暴露在最小辐射剂量。辐射损伤DNA,可能阻断细胞增殖,诱导细胞死亡。健康的细胞能够快速修复自己,存活和正常功能。放疗通常和化疗、手术、免疫治疗联合使用。虽然放疗是有益的,但也有一些副作用,例如口腔粘膜炎、肝毒性和肾毒性
靶向放射性核素治疗(Targeted radionuclide therapy,TRNT)可用于向恶性细胞传递辐射,同时对健康细胞影响最小。有两种类型的TRNT药物:1.恶性组织中自然积累的碘-131、锶-89等,2.靶向细胞表面表达的肿瘤相关抗原的TRNT药物。
纳米抗体良好的组织穿透性,标记反射性核素靶向肿瘤相关抗原,实现靶向反射治疗。现在开始有一些动物模型的研究,显示出良好结果。
有一项临床试验注册(NCT03956615),但尚未申请。
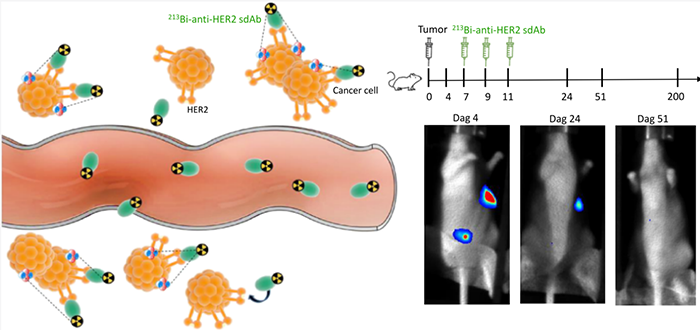
HER2单域抗体标记213Bi靶向放疗(Mol. Pharm. 2020, 17, 3553–3566.)
递送化疗药物
抗体偶联药物利用抗体特异性靶向功能,将细胞毒性药物携带至肿瘤局部。传统抗体含有Fc段,因为Fc和受体的结合而引起额外的免疫毒性及代谢异常。纳米抗体不含Fc段,且组织穿透性好,理论上可以减少额外副作用发生,增加肿瘤局部的药物,从而减少抗体欧联药物的系统用量,增加治疗指数。
纳米抗体还可以被用于封装药物,还可提高溶解度、稳定性和清除率。
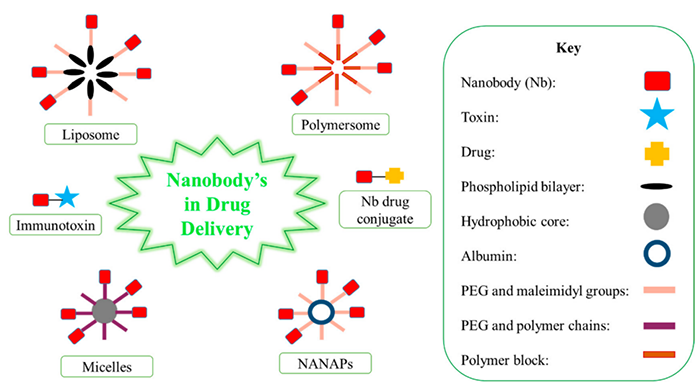
纳米抗体用作药物递送载体的几种可能形式
免疫治疗
肿瘤免疫治疗已经有百年历史,包括疫苗、细胞因子、抗体药物、免疫检查点抑制剂、细胞治疗等多种技术。
纳米抗体由于其分子量小的特点,对于实体瘤穿透性更高,相同靶点的纳米抗体,可能产生比传统抗体更好的治疗效果。
KN035
康宁杰瑞原研的PD-L1单域抗体,目前和先声、思路迪等合作开展多项肿瘤治疗临床试验(NCT03667170,NCT04034823, NCT04182789等)。
小结
纳米抗体因为分子量小,组织穿透性好;可以原核表达,成本低;结构稳定,易于运输等特点,吸引了广泛的关注。现在已经开始有一些纳米抗体的临床试验用于影像诊断、手术治疗、免疫治疗等领域。
文章来源:生物制药小编
主要参考文献
1.Ivana Jovčevska et al,The Therapeutic Potential of Nanobodies,BioDrugs . 2020 Feb;34(1):11-26.
2.Yan Xing et al,Early Phase I Study of a 99mTc-Labeled Anti–Programmed Death Ligand-1 (PD-L1) Single-Domain Antibody in SPECT/CT Assessment of PD-L1 Expression in Non–Small Cell Lung Cancer,J Nucl Med 2019; 60:1213–1220
3.D’Huyvetter, M.; Xavier, C.; Caveliers, V.; Lahoutte, T.; Muyldermans, S.; Devoogdt, N. Radiolabeled nanobodies as theranostic tools in targeted radionuclide therapy of cancer. Expert Opin. Drug Deliv. 2014, 11, 1939–1954
4.Dekempeneer, Y.; Caveliers, V.; Ooms, M.; Maertens, D.; Gysemans, M.; Lahoutte, T.; Xavier, C.; Lecocq, Q.; Maes, K.; Covens, P.; et al. Therapeutic Efficacy of 213Bi-labeled sdAbs in a Preclinical Model of Ovarian Cancer. Mol. Pharm. 2020, 17, 3553–3566.
5.Rosenfeld, L.; Sananes, A.; Zur, Y.; Cohen, S.; Dhara, K.; Gelkop, S.; Ben Zeev, E.; Shahar, A.; Lobel, L.; Akabayov, B.; et al. Nanobodies Targeting Prostate-Specific Membrane Antigen for the Imaging and Therapy of Prostate Cancer. J. Med. Chem. 2020, 63, 7601–7615
6.Zhang, F.; Wei, H.; Wang, X.; Bai, Y.; Wang, P.; Wu, J.; Jiang, X.; Wang, Y.; Cai, H.; Xu, T.; et al. Structural basis of a novel PD-L1 nanobody for immune checkpoint blockade. Cell Discov. 2017, 3, 17004
7.Naidoo, D.B.; Chuturgoon, A.A. Nanobodies Enhancing Cancer Visualization, Diagnosis and Therapeutics. Int. J. Mol. Sci. 2021, 22, 9778.














