嵌合抗原受体(CAR)T细胞在治疗恶性血液病方面取得了很大的成功,但在治疗实体瘤方面效果不佳,部分原因是由于嵌合抗原受体(CAR)T细胞的获得性差和肿瘤微环境的免疫抑制。此外,CAR-T治疗可能引起潜在的危及生命的副作用,包括细胞因子释放综合征和神经毒性。目前对CAR-T治疗效果的临床前测试通常是在小鼠肿瘤模型中进行的,这往往无法预测毒性。在人源化模型和转基因小鼠以及非人灵长类动物模型方面的最新进展正被用于评估CAR-T细胞的有效性和毒性。然而,并没有一个单一的模型能够完美地概括人体免疫系统和肿瘤微环境,因此根据它们各自的优缺点仔细选择模型对于充分评估不同的CAR-T治疗方法至关重要,以便更好地支持它们的临床开发。
在临床前阶段对CAR-T疗法进行药理学建模通常需要解决以下关键问题。首先,设计和构建的CAR-T细胞是否通过特定地结合预定的靶点(靶点效力,不包括同种异体反应)来杀死靶癌细胞,这可以用体外培养系统或体内异种移植模型中的任何一种来评估。其次,药物的药代动力学参数是否可以在体内给药后监测其分布,持续时间和亚型鉴定。这需要专门开发的生物分析方法和异种移植建模。第三,是否可以使用动物模型评估药物毒理学性质的某些方面。在啮齿动物模型中,通常需要人源化的小鼠,但要注意CAR-T的移植物抗宿主病(GvHD)效应。最后,是否可以通过各种细胞系/器官的体外筛选和活体确认来确定临床适应症。
体外模型
随着CAR设计、基因工程和制造的改进,在开发的早期阶段评估CAR-T细胞疗法的特异性、有效性,并进行优化,对于为更复杂的活体系统选择正确的CAR-T产品以及确定临床适应症和潜在毒性至关重要。影响CAR-T细胞效力和特异性的因素有很多,包括CAR结构/设计、转染效率、培养条件和细胞类型。体外系统为CAR-T细胞疗法的评估提供了一系列不同的检测方法,检测方法的选择取决于CAR的类型、靶点、质量和发展阶段。
通常,CAR-T细胞与阳性/高和阴性/低靶表达细胞类型的共培养可以深入了解CAR结构的药理学,其中对靶表达细胞的T细胞激活和细胞死亡的定量可以显示出治疗的几个关键属性,如特异性和有效性。首先,在选择细胞系进行培养实验之前,需要确认靶抗原的表达程度,通常是通过RNAseq、IHC或流式细胞术。其次,TAA通常不仅在靶肿瘤细胞如肿瘤器官中表达,而且在一些正常细胞中也有表达。CAR-T是否表现出足够的治疗窗口期可以通过CAR-T与肿瘤器官或正常器官共培养来评估。另一方面,所设计的CAR-T是否能有效区分两种抗原,其预期的TAA靶点可能是与正常对照具有相似结构的癌基因突变体/异构体。表达接近靶标同源物的工程化细胞系可以用来确定这种特异性和任何潜在的靶外效应。第三,CAR-T介导的杀伤力可以通过在共培养试验中包括多重效靶比和时间点来确定。这样会对特定CAR-T的可行性和潜在的剂量信息有更深入的了解。最后,针对不同癌症类型的不同模型进行共培养评估有助于确定临床适应证。
另外在体外系统中,可以有效地确定一种特定的CAR是否可以克服对其他CAR-T细胞疗法的复发或难治性反应。例如,尽管观察到CD19 CAR-T细胞疗法的显著反应,但一部分患者在治疗后复发。开发针对不同B细胞标志物的替代CAR是一个高度未得到满足的需求领域。其中一个靶点是CD37,它在多种类型的B细胞淋巴瘤中高度表达。在CD37 CAR-T细胞与B细胞淋巴瘤细胞系共培养的体外细胞毒性和T细胞功能方面,显示出与CD19 CAR-T细胞相似的数据,在CD19-细胞系中表现出显著的肿瘤杀伤作用。
小鼠动物模型
用于CAR-T治疗的动物模型的主要特点如下:1)模型需要具有所设计的CAR能够识别的具有人类靶点的肿瘤;2)模型不应排斥CAR-T细胞;3)理想情况下,模型具有合适的宿主环境,包括人体免疫和TME,使CAR-T细胞能够穿透并与宿主细胞相互作用;4) 尽管人类肿瘤异种移植模型最常用于CAR-T研究。但有时小鼠肿瘤模型也可以作为研究工具来研究小鼠CAR-T的作用机制和概念验证。图1总结了应用于CAR-T细胞评价的小鼠模型。
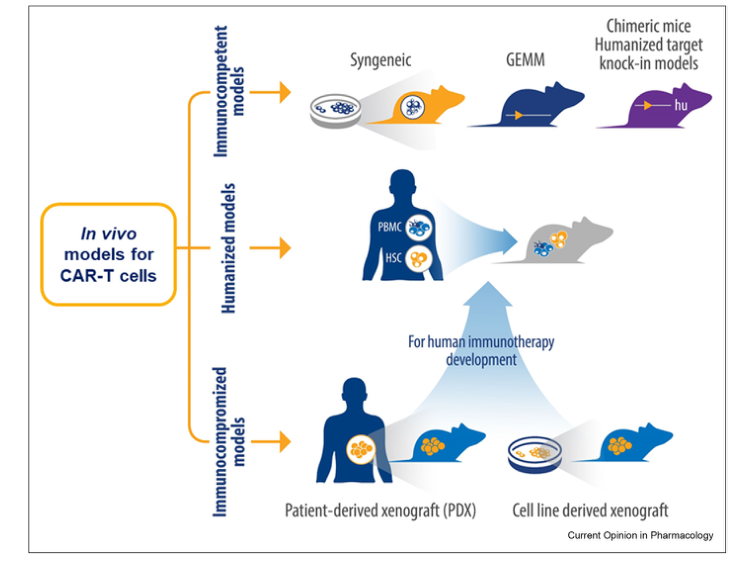
图1.研究CAR-T的功效的小鼠动物模型
图2总结了异种移植、人源化、同基因和转基因小鼠模型的优缺点,以突出在选择模型时需要考虑的关键特征,这里不再详细介绍。根据研究目的仔细选择临床前模型可以更好地预测CAR-T疗法在人类患者中的有效性和毒性。
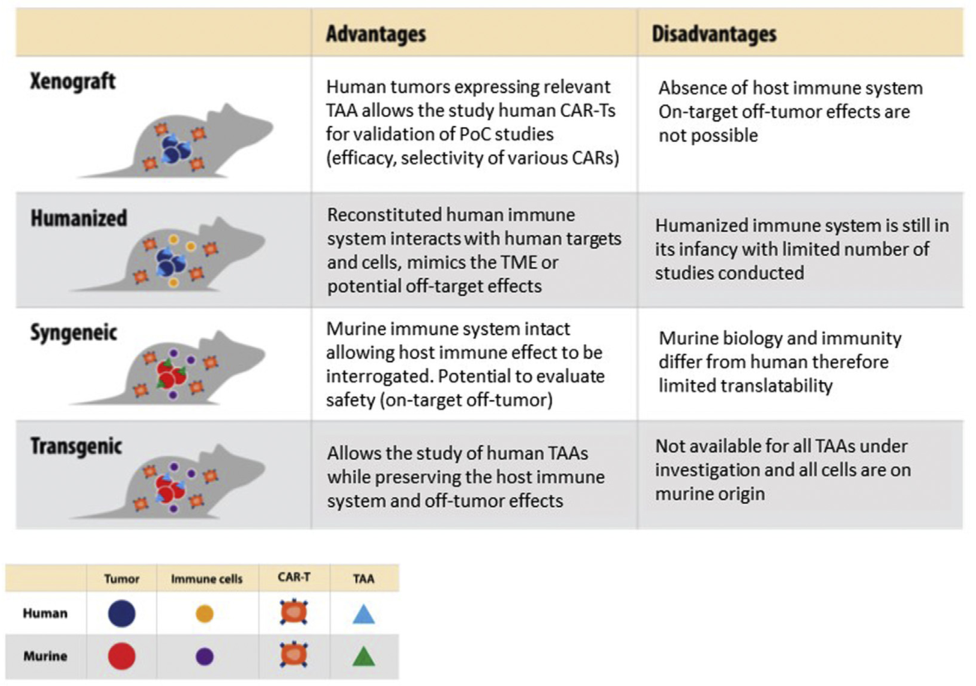
图2. 异种移植、人源化、同基因和转基因模型的优缺点
用于安全评估的非人灵长类(NHP)模型
目前几乎所有的临床前CAR-T研究都是在小鼠身上进行的,包括同基因小鼠模型、异种小鼠模型、转基因小鼠模型和人源化小鼠模型。最近,一些研究开始使用NHP模型来更好地模拟临床副作用。与啮齿动物相比,NHP与人类有更高的同源性,在一个完整的免疫系统中,也有类似的疾病进展。因此,NHP疾病模型在评估物种限制性生物制品方面更可行,在评估免疫相关毒性和潜在致命临床毒性(如CRS)方面更具临床相关性。
第一个评估NHP中CAR-T细胞的研究调查了受体酪氨酸激酶样孤儿受体1(ROR1),它在胚胎发育过程中表达,除了B细胞前体外,在成人组织中不存在。由于ROR1在许多淋巴管和上皮性恶性肿瘤中高表达,并且在猕猴和人类之间高度保守,因此被认为是T细胞治疗的潜在候选靶点。该研究的目的是确定过继转移自体ROR1 CAR-T细胞后,正常细胞中低水平的ROR1表达是否会导致毒性。目前还并未有毒性的报道。
虽然在NHP中预测CAR-T的毒性具有显著的优势,但仍有一些局限性,由于伦理和金钱原因,这些灵长类动物模型只有在小鼠模型得到广泛验证后才被使用,另外它也不能完全模拟人体内CAR-T细胞的反应。
小结
临床前模型为CART细胞的有效性、特异性和毒性提供了一些有价值的见解,但通常一个模型不足以提供对给定CAR-T疗法的全面了解。在进入临床试验之前,可以根据它们的优点和缺点使用多种不同的模型,以提供对有效性和安全性的更加全面的了解。
文章来源:生物制药小编
参考文献
1.Preclinical pharmacology modeling of chimeric antigen receptor T therapies.
2.Preclinical models in chimeric antigen receptor–Engineered T-Cell Therapy.














