和CAR-T细胞不同,NK细胞生命周期短,体内扩增受限,因而提高了其安全性,即使是异体细胞过继治疗,也相对安全,几乎不发生CRS和神经毒性,使得NK细胞可以做成off-the-shelf的产品,增加细胞治疗可及性。

CAR-T目前使用自体细胞移植,而CAR-NK除了自体来源NK细胞,还可以使用NK细胞系,干细胞分化NK,脐带血NK细胞等。
外周血NK细胞(PB-NK)
NK细胞可以相对容易地从患者本身(自体PB-NK)或健康供体(异体PB-NK)中分离出来,因此大多数(31/33)临床前CAR-NK研究使用PB-NK。
对于癌症免疫治疗,自体NK细胞通常不是很有效,因为当它们遇到自身MHC抗原时,功能上被沉默。此外,患者来源的NK细胞的功能往往受到潜在疾病或预防治疗的损害。因此,异基因PB-NK通常是免疫治疗的首选,但是需要仔细清除产品中的T淋巴细胞,因为这些细胞可以诱导GVHD。
由于外周血中的NK细胞数量较低,NK细胞在分离后常规扩增。NK细胞的治疗通常输注量为105-108个细胞/kg,因此对于体重为100kg的患者需要多达1010个NK细胞。
PB-NK细胞用于癌症免疫治疗的主要优势是,细胞已经成熟,不需要经历一个长时间的分化。另一方面,PB-NK的转导效率相对较低,延长培养时间往往导致端粒酶缩短和耗竭,导致的细胞毒性降低。
脐带血来源NK细胞(UCB-NK)
PB-NK细胞的一个可能限制是依赖于健康供体的可用性。新诊断病人,往往其自身NK细胞并不符合临床治疗的需要,冷冻保存的成熟PB-NK细胞,细胞活力和细胞毒性显著降低,因而限制了CAR-NK临床使用。
脐带血是一个比较稳定的NK细胞来源。一般来说,由于这些细胞的高增殖能力,只需要一个脐带血单位的10%就可以在两周内产生一个几乎超过109个NK细胞的纯细胞池,通常适用于一个治疗周期。
UCB-NK细胞的另一个优点是,样本的单倍型可以在收集时确定,允许生成一个细胞库,可以根据需要选择HLA不匹配的NK细胞。
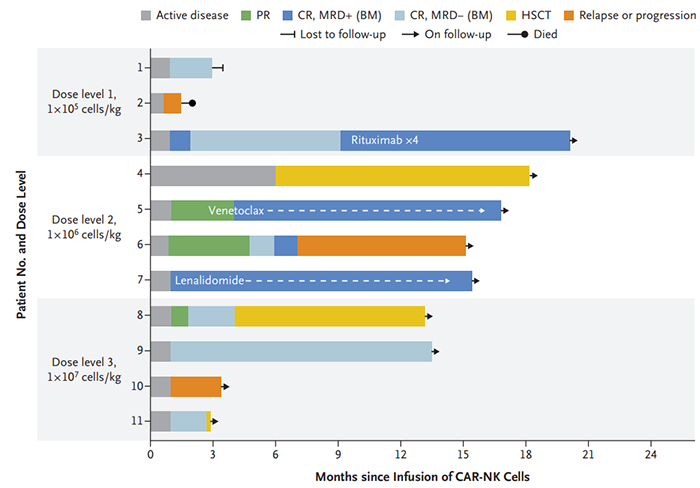
由M.D. Anderson Cancer Center进行的临床研究(NCT03056339),脐带血来源的CD19 CAR-NK细胞治疗11例复发或难治性血液肿瘤,8例(73%)有反应,7例达到CR(文献2)。
干细胞分化NK细胞
PB-NK和UCB-NK作为CAR-NK发育的细胞来源的缺点包括供体之间的自然异质性,导致NK细胞产品的性能差异。因此,干细胞来源的NK细胞扩增是开发标准化的治疗产品的一个有吸引力的替代方案。
从人类胚胎干细胞(hESC)或诱导多能干细胞(诱导PSC)产生临床治疗规模NK细胞,已经证实可行。常用的hESC/iPSC细胞通常比使用来自骨髓活检、G-CSF动员或人类胚胎的干细胞更可取。除了使用这些来源细胞附带的伦理问题外,从原代干细胞开始的NK细胞诱导的结果难以预测,而且往往不那么有效。
从hESC或诱导多能干细胞产生NK细胞需要3-5周,来自H9 hESC细胞的NK细胞表现出有限的异体免疫反应,而与UCB-NK相比,它们表现出更成熟的细胞毒性表型。另一方面,iPSC来源的NK细胞已经被证明具有对抗肿瘤的功能,最近已被用于生成CAR-NK细胞。在优化了用于iPSC来源的NK细胞的激活域后,间皮素靶向iPSC CAR-NK细胞被证明与CAR-T细胞一样有效。在小鼠异种移植模型中,与CAR-NK治疗相比,CAR-iPSC-NK治疗的荷瘤小鼠表现出更少的致病性器官损伤和更低的IFN-γ和IL-6水平。
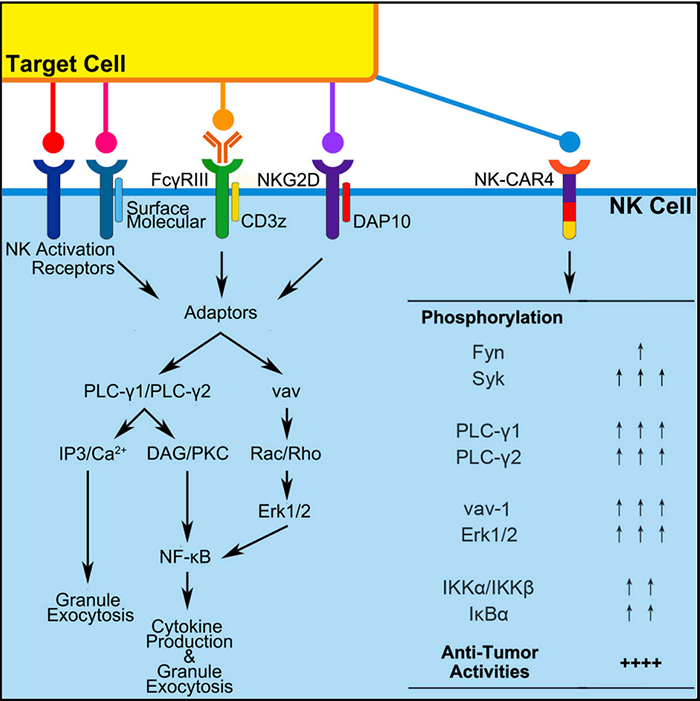
CAR-iPSC-NK(Cell Stem Cell. 2018;23(2):181–92.)
但是iPSC CAR-NK应用于临床,还有一些挑战:首先,在小鼠模型中,在停止外源性给予细胞因子后,CAR-iPSC-NK细胞在体内停止增殖。在临床环境中全身给药细胞因子是非常不可取的,因为它不仅昂贵,而且有潜在的危险。其次,iPSC来源的细胞总是具有恶性转化的潜力。最后,iPSC来源的细胞具有潜在的免疫原性,这可能导致胚胎干细胞的破坏,甚至导致不良的免疫反应,如细胞因子释放风暴。
NK细胞系
上述三种NK细胞来源有一个主要的共同缺点:获得大量的NK细胞相对繁琐和耗时。一般来说,细胞系可以绕过大多数这些问题,因为它们很容易维护和扩展。因此,有72项实验研究报道了使用NK细胞系开发CAR-NK细胞也就不足为奇了。其中80%以上的研究使用了淋巴瘤来源的NK-92细胞系。
在现有的6个NK细胞系中,NK-92具有较高的抗肿瘤活性,并具有直接的细胞毒性。当NK-92细胞转染CD16时,该细胞系也可以触发抗体依赖的细胞介导的细胞毒性(ADCC)。
对于CAR-NK细胞开发,NK-92细胞还有另一个主要优势:该细胞系也可以很容易地使用非病毒方法进行基因修饰,包括电穿孔。
到目前为止,NK-92临床前研究,已经涉及AML、淋巴瘤(CD19)、骨髓瘤(CS1)、前列腺癌(EpCAM)、前列腺癌(CAR、乳腺癌(Her2)、GD2)、神经母细胞瘤(GD2)、胶质母细胞瘤(EGFR)和卵巢癌(间皮素)。
NK-92细胞系的主要缺点之一是这些细胞是肿瘤来源的,是非整倍体。因此,它们需要在输注前进行辐射,防止体内增殖和限制其寿命。
在I期试验中,NK-92给药被证明是安全的,只有轻微的反应。原代CAR-NK细胞与NK-92细胞的头对头比较数量有限。
在一项使用CdD23靶向CAR的研究中显示,原代NK细胞在体外根除AML细胞方面的效率不如NK-92细胞(文献5)。
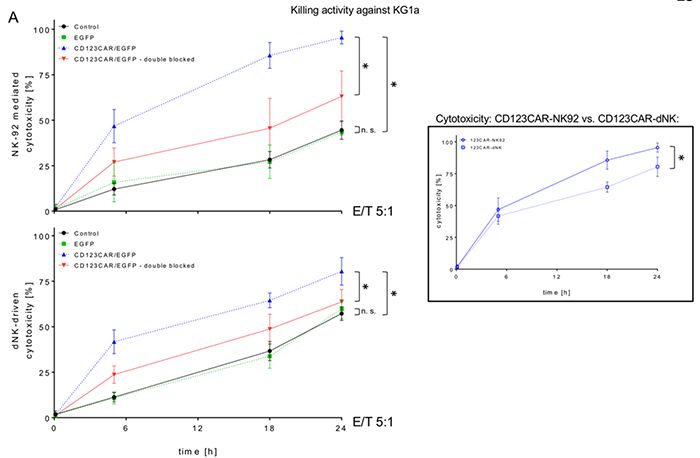
这可能是由于原代NK细胞中CAR的表面表达水平较低所致。
然而,由于NK-92细胞具有复制能力,辐照的CAR-NK-92细胞在患者的总生存率方面是否优于原代CAR-NK细胞,还需要等待未来的临床结果。
目前NK-92细胞系的临床试验有:NCT03383978,NCT02839954,NCT02742727,NCT02892695,NCT03940833,NCT03941457,NCT02944162,NCT04052061,NCT04050709。
小编总结
CAR-NK有成为off-the-shelf细胞治疗产品的可能,受到越来越多的关注,目前有超过20项临床试验开始开展。了解CAR-NK细胞的四种来源,及每种来源的优缺点,有助于选择合适的NK细胞原料,设计生产符合治疗目的的产品。
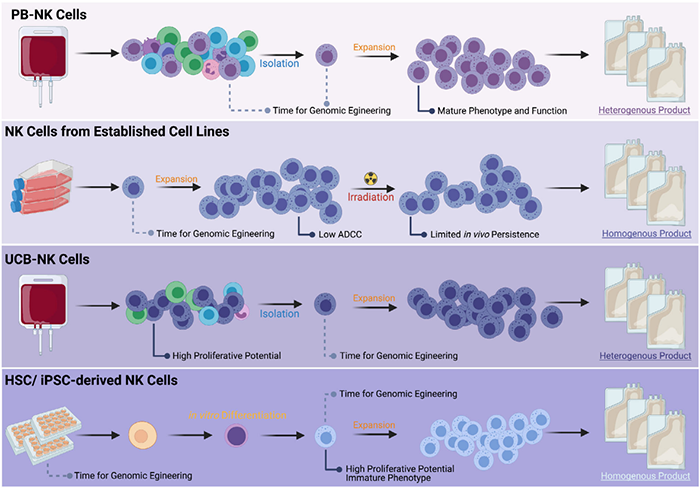
四种CAR-NK来源及优缺点(Clin Transl Immunology. 2021 Apr 28;10(4):e1274.)
来源:生物制药小编
Daher M, Melo Garcia L, Li Y, Rezvani K.CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 2021 Apr 28;10(4):e1274. Liu E, Marin D, Banerjee P, Macapinlac HA, Thompson P, Basar R, Nassif Kerbauy L, Overman B, Thall P, Kaplan M, et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 2020;382(6):545–53 Li Y, Hermanson DL, Moriarity BS, Kaufman DS. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 2018;23(2):181–92. Lu H, Zhao X, Li Z, Hu Y and Wang H (2021) From CAR-T Cells to CAR-NK Cells: A Developing Immunotherapy Method for Hematological Malignancies. Front. Oncol. 11:720501. doi: 10.3389/fonc.2021.720501 Kloess S, Oberschmidt O, Dahlke J, Vu XK, Neudoerf C, Kloos A, Gardlowski T, Matthies N, Heuser M, Meyer J, et al. Preclinical assessment of suitable natural killer cell sources for chimeric antigen receptor natural killer-based “Of-the-Shelf” acute myeloid leukemia immunotherapies. Hum Gene Ther. 2019;30(4):381–401














