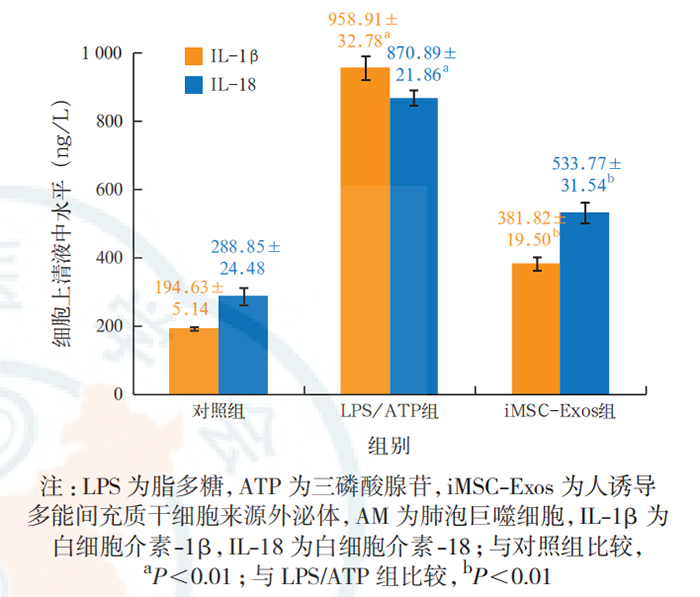
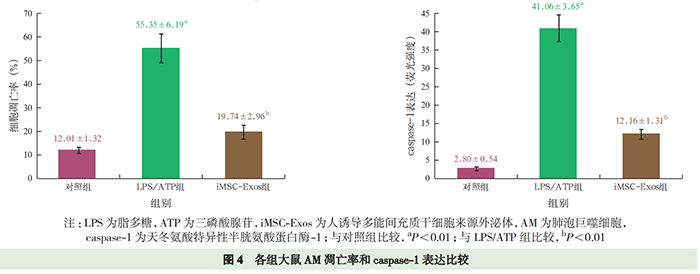
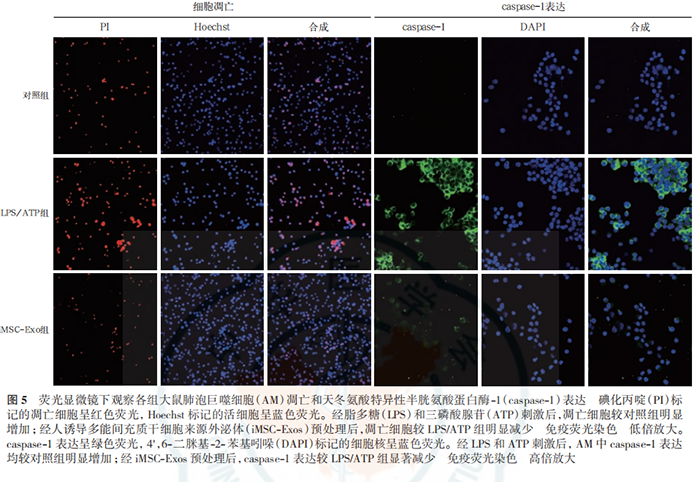
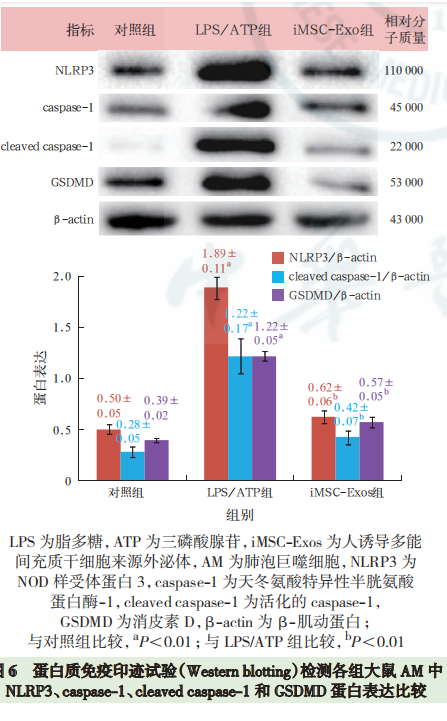
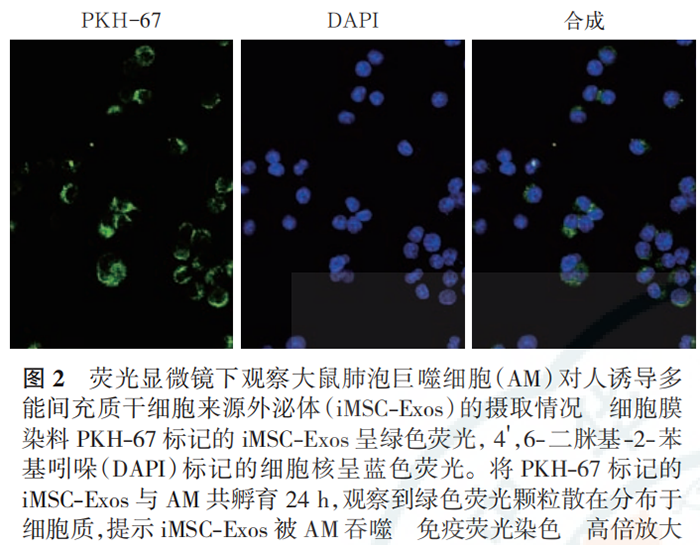
蛋白质免疫印迹试验(Western blotting)检测外泌体标志性蛋白表达:提取外泌体,蛋白定量后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),转膜、封闭;依次加入抗 CD63、CD9 一抗(均 1∶1 000),4 ℃孵育过夜;洗膜后加入相应二抗,室温孵育 1 h;洗膜后加入增强化学发光试剂,采用曝光机成像并拍照。 透射电镜下观察外泌体的形态:吸取充分混匀的提取物 20 μL 滴到孔径 2 mm 的载样铜网上,室温静置 5 min,滴加醋酸双氧铀复染 2 min,室温下晾干; 将样品置于透射电镜下成像并拍照。 外泌体直径检测:用 PBS 稀释样品,向样品板中加入 100 μL 稀释液,应用 iZON 颗粒分析仪,采用高分辨率可调电阻脉冲检测样品颗粒直径。 外泌体荧光标记:将 PBS 重悬的外泌体稀释后加入 4 μL PKH-67 染色液,室温下孵育 5 min;加入0.1% 胎牛血清 2 mL 终止染色;转移到外泌体旋转柱中,4 ℃离心 2 min;收集 PKH-67 标记的外泌体与 AM 共孵育 24 h,并采用 4',6- 二脒基-2- 苯基吲哚(4', 6-diamidino-2-phenylindole dihydrochloride,DAPI)标记细胞核,于荧光显微镜下观察 AM 摄取外泌体的情况并拍照。 实验分组及处理:将细胞分为 3 组。LPS/ATP组细胞经 500 μg/L 的 LPS 刺激 23 h 后加入 5 mmol/L ATP刺激1 h诱导细胞焦亡;iMSC-Exos组用100 mg/L(蛋白定量)iMSC-Exos 预处理 AM 3 h 后再予以 LPS和 ATP 刺激;对照组在细胞上清液中加等量 PBS。24 h 后收集细胞及细胞上清液,进行后续实验检测。 细胞活性实验 乳酸脱氢酶(lactate dehydrogenase,LDH)检测 Western blotting 检测 NLRP3 炎症小体途径及焦亡相关蛋白消皮素D (gasdermin D,GSDMD)表达 细胞培养上清液中白细胞介素(interleukins,IL-1β、IL-18)测定 细胞凋亡检测 免疫荧光法检测细胞 caspase-1 的表达 iMSC-Exos 的鉴定:透射电镜下观察(图 1A),外泌体结构完整,呈圆形囊泡状。Western blotting 显示(图 1B),外泌体特异性生物标志物 CD63、CD9 在iMSC-Exos 中呈阳性表达,但不表达 GAPDH。高分辨率可调电阻脉冲检测显示,粒子直径众数 90 nm,平均直径 130 nm,提示成功提取到 iMSC-Exos。 AM 对 iMSC-Exos 的摄取(图 2):荧光显微镜下显示,将 PKH-67 标记的 iMSC-Exos 与 AM 共培养24 h 后,iMSC-Exos 被 AM 摄取并转移到细胞质中,提示 iMSC-Exos 能够被 AM 吞噬。 iMSC-Exos 对 AM 焦亡炎症反应的影响(图 3):给予 LPS和 ATP刺激后,细胞上清液中 IL-1β、IL-18水平较对照组显著升高(均 P<0.01);与 LPS/ATP组相比,iMSC-Exos 预处理后,AM 分泌 IL-1β、IL-18水平显著下降(均 P<0.01),提示 iMSC-Exos 能逆转AM 焦亡后释放的炎性因子水平。 iMSC-Exos 对 AM 焦亡的作用机制(图 4~6):经 LPS 和 ATP 刺激后,AM 凋亡率及 caspase-1 表达均较对照组明显增加(均 P<0.01);经 iMSC-Exos 预处理后,细胞凋亡率及 caspase-1 表达较 LPS/ATP 组显著下降(均 P<0.01)。此外,LPS/ATP 组 NLRP3、cleaved caspase-1 及 GSDMD 的蛋白表达水平均较对照组显著升高(均 P<0.01);与 LPS/ATP 组相比,经iMSC-Exos 预处理后,NLRP3、cleaved caspase-1 及GSDMD 的蛋白表达水平均显著下降(均 P<0.01)。表明 iMSC-Exos 可能经 NLRP3 炎症小体途径抑制AM 焦亡。 ,文献来源: 彭巍 , 江榕 , 李勇 , 陈家泉 , 邵强 , 钱克俭 , 刘芬 - 《中华危重病急救医学》 - 2021年1期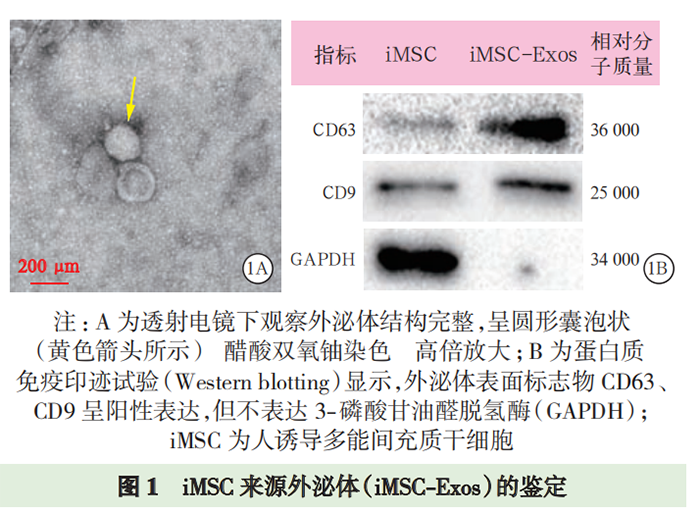
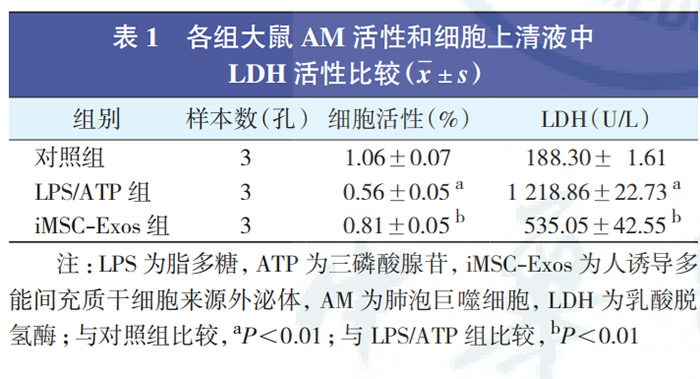
iMSC-Exos 对 AM 焦亡毒活性的影响(表 1):在使用 LPS 和 ATP 刺激后,AM 活性较对照组显著下降,而坏死物质 LDH 的释放量较对照组显著增加(均P<0.01)。给予 iMSC-Exos预处理后,与 LPS/ATP组相比,iMSC-Exos 组 AM 活性显著升高,LDH 活性显著下降(均 P<0.01)。提示 iMSC-Exos 能增强 AM活性,减少细胞坏死。