从上世纪80年代开始,质谱应用于蛋白质磷酸化的检测中,极大的推动了磷酸化蛋白质组的发展。因为质谱拥有高灵敏度、高通量的特点,并且具有位点分辨率,因此基于质谱的磷酸化蛋白质组检测方法得到不断的发展和推广。
磷酸化蛋白质组数据的可重复性和可信度依赖于质谱仪的扫描速度和灵敏度,近年来几乎所有的磷酸化蛋白质组检测都是采用串联质谱(MS/MS),其中包括qTOF, LIT-Orbitrap,quadrupole-Orbitrap和FTICR质谱。其中近年来应用较多的的Orbitrap Fusion,扫描频率达22Hz,快速的扫描能够增加检测深度和检测通量。Gygi et al,2014,利用Orbitrap Fusion和多同位素标记策略,在10种样品中鉴定到11000个磷酸化位点。所需机时也大幅减少,从一周缩短为两天。而Q-Exactive HF,能够通过分段四级杆精确选择母离子。Olsen研究组报道,利用RPLC和Q-Exactive HF能够从Hela中鉴定到7600个unique磷酸化肽段。同时发现,提高子离子的谱图质量,对鉴定深度有所帮助,不过这需要牺牲一定的扫描速度。
MS数据获取方法
蛋白质组通常采用的数据获取方式是数据依赖型获取方案(Data-dependent acquisition,DDA),该方法能够自动选择母离子并进行碎裂检测。通常该方法选择丰度较高的母离子,忽略了丰度较低的磷酸化肽段。近年来逐渐发展的数据非依赖获取方案(Data-independent acquisition,DIA),将检测范围设置成不同的m/z范围(比如SWATH),理论上能够检测所有的离子。对DDA和DIA的方法比较,发现靶向DIA方法能够提高检测的灵敏度5-10倍。不过该方法造成数据量增加,复杂度提高,解谱更加困难。结合DDA、DIA和靶向检测方法,能够结合各方法的优势,如2012年Narumi 等在乳腺癌样本中利用DDA进行了全蛋白检测,同时利用靶向DIA鉴定生物标志物。
基本定量方法
磷酸化蛋白质组的定量,与普通蛋白质组定量不同的是,同一个蛋白不同位点,可能具有不同的磷酸化水平,因此定量是需要直接检测磷酸化肽段,基于位点的定量。对于肽段的定量方法也有很多种,基本可以分为有标定量和无标定量。
有标定量是已经活跃了近20年的定量方法,包括氨基酸细胞培养基稳定同位素标记的SILAC方法,氨基修饰标签的mTRAQ方法,以及二甲基标记方法。这些方法可以满足多个样品不同标记,因此样品可以混合成单针进行检测。这些都是一级定量所使用的标记方法,与此同时,也有很多成熟的二级定量方法,如TMT和iTRAQ,能够同时定量6-10个样品。不过这种定量方式覆盖深度会受到影响。有标定量的一个突出的限制是信号压缩效应,分配到一起的母离子,原本的比值差异可能会被压缩到不显著。
近年来也不断涌现了很多新的标记方法,比如Xue等在2014年先将肽段全部去掉磷酸化,然后体外用18O-ATP作为原料,在特定激酶作用下肽段发生磷酸化修饰,修饰位点具有18O修饰。该方法可以研究激酶直接的作用底物。
无标定量没有同位素标记,是一种相对定量方法,该方法以其费用低,灵活性强,易于实验设计等优点受到欢迎。虽然该方法不能将样品混合,消耗检测机时会更多,但前期样品准备简单,易于进行预分离,仍成为使用最广泛的方法。无标定量的挑战还是在数据获取后的分析中,像Skyline和MaxQuant发展出比较成熟的磷酸化定量方法,并且MaxQuant提出match between runs的思路尝试解决磷酸化检测中常出现的空值问题,虽然这一方法有可能引入更多的不确定性。
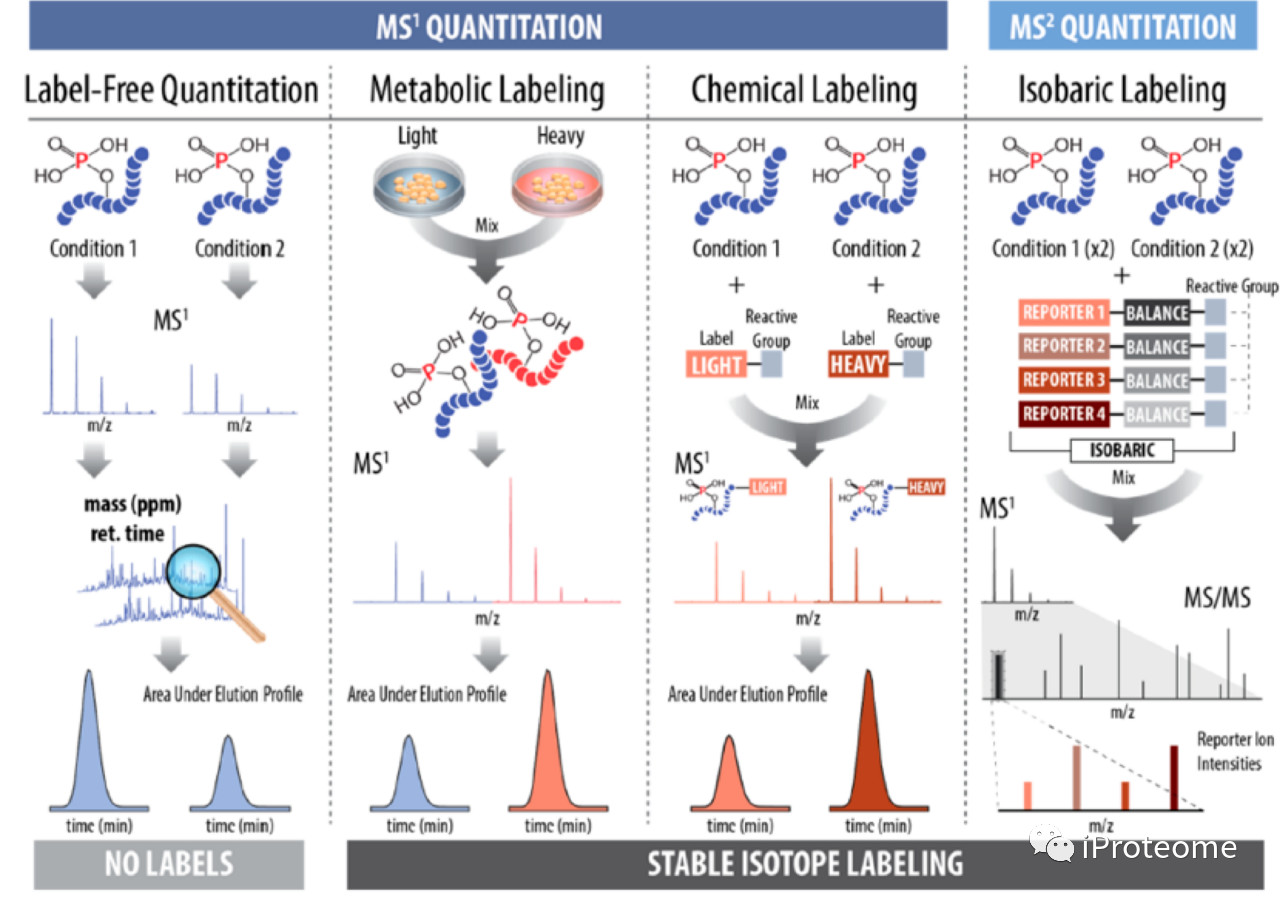
图1 不同的磷酸化蛋白质组检测策略
磷酸化位点鉴定和定量质控
质谱提供磷酸化修饰等翻译后修饰的优点在于其位点分辨率,但是在实际应用过程中,因为对位点的评估不能满足可信度要求,约有20-40%的磷酸化肽段数据不可用。
对磷酸化修饰的质控,往往是以磷酸化肽段的子离子为中心。常用的CAD(collisional activation dissociation)碎裂模式虽然方法简便,但是容易引起位点重排,N末端附近修饰位点中性丢失增加等问题。ETD(electron transfer dissociation)是逐渐成熟起来的应用于磷酸化蛋白质组检测中的肽段碎裂方法。该方法可以有效保留肽段骨架信息和磷酸化修饰信息,不过当母离子电荷低时,碎裂效率会降低。2012年,Heck实验室提出EThcD方法。这种方法比HCD鉴定的磷酸化肽段会少一些,但是序列覆盖度和位点鉴定比例比HCD和ETD都高。
负电模式检测可能是磷酸化蛋白质组的另一个维度。因为磷酸化上带负电,使其更易去质子化,形成阴离子。因此在碎裂过程中,对形成的阴离子检测,可能更能帮助解析高通量的磷酸化蛋白质组问题。
展望
人们逐渐认识到,耗费大量的检测时间,对覆盖深度的贡献是有限的。而随着技术的进步,单针的检测能够达到很深的覆盖度。在数小时的检测中,单针能够鉴定15000-20000个磷酸化位点。同时,单针检测具有更好的重复性,更短的数据分析时间。因此,磷酸化蛋白质组的检测向单针检测发展。
磷酸化蛋白组目前面临的主要问题是数据之间的重复性问题。技术重复之间的磷酸化肽段重合约为60%-75%。重复样本间进行鉴定量的累积,增加重复样本可以避免缺失值。不过在追求高效,降低数据复杂度的单针检测时代,怎样获得可重复的数据是需要解决的主要问题。
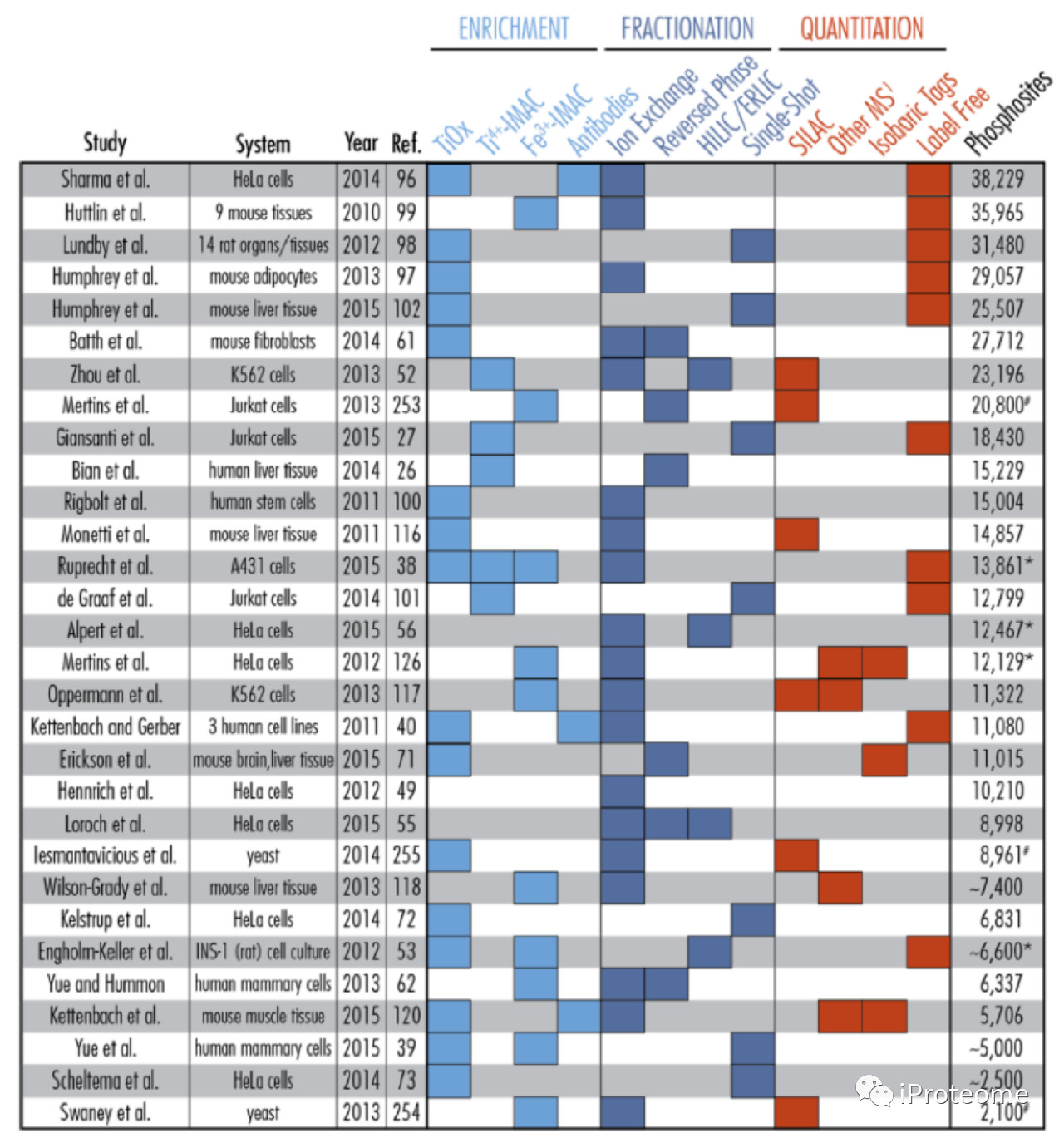
图2 磷酸化蛋白质组研究概览
Reference:
Riley N M, Coon J J. Phosphoproteomics in theage of rapid and deep proteome profiling[J]. Analytical chemistry, 2015, 88(1):74-94.
Erickson B K, Jedrychowski M P, McAlister G C,et al. Evaluating multiplexed quantitative phosphopeptide analysis on a hybridquadrupole mass filter/linear ion trap/orbitrap mass spectrometer[J].Analytical chemistry, 2015, 87(2): 1241-1249.
Pierobon M, Wulfkuhle J, Liotta L, et al.Application of molecular technologies for phosphoproteomic analysis of clinicalsamples[J]. Oncogene, 2015, 34(7): 805.
Maes E, Tirez K, Baggerman G, et al. The use ofelemental mass spectrometry in phosphoproteomic applications[J]. Massspectrometry reviews, 2016, 35(3): 350-360.
来源:iproteome














