1
—
为什么要确定RNA的质量
与DNA不同,RNA是极为脆弱的,由于其单链结构,RNA的碱基和氢键全都暴露在环境中,极易被环境中的各种化学物质和RNA酶降解。一旦降解,后期的实验纯属浪费时间了,然而这一过程往往是不易察觉。
良好的实验环境和准确的实验流程控制是保证实验成功的基本条件。外源性酶是影响实验的重要因素。下图为*春雨实验室的错误做法,你的实验失败很可能是因为别人在旁边吃了一顿饭......
作为“脱发重灾领域”,RNA实验需要我们在实验流程中不断自查是否存在问题,而RNA质量检测就是重要的一环。如果RNA质量存在问题,后期的实验结果会惨不忍睹,什么样的都有。
闲话不多说,下面就介绍3种评价RNA质量方法。
2
—
吸光度法测RNA总量
即紫外分光光度计检测,经常使用。
280、320、230、260nm下的吸光度分别代表了核酸、溶液浑浊度、盐浓度和蛋白等有机物的值。我们只看OD260/OD280。理论上,纯RNA情况下的OD260/OD280的值为2,可接受的范围为1.8-2.0。纯的DNA情况下的OD260/OD280的值为1.8,可接受的范围是1.6-1.8。
一般认为RNA中的蛋白或是其他有机物的污染是可以接受的,当R<1.8时,溶液中蛋白或是酚类物质残留。当R>2.2时,说明RNA已经水解为单核酸。一般的,如果你能做到1.9-2.0之间,说明RNA纯度已经很高了。但是如果你采用Tris作为缓冲液检测吸光度时,R值可能会>2(一般应<2.2的)。
个人推荐的办法是严格采用阈值1.8-2.0作为判定标准,不符合的RNA样品丢弃,重新提取,这样才能最小化误差。
3
—
电泳法谱测RNA完整性
一般而言,RNA琼脂糖实验是为了检测RNA的完整性,但是我们也可以从中看出RNA的质量好坏。
我们的目的并不是要检测RNA的分子量,RNA无需变性,所以采用普通的1%含EB琼脂糖凝胶(含EB)即可满足要求。跑胶结束后,在紫外灯的照射下,我们可以得到如下的图。

4
—
保温法RNA是否酶污染
上面2种方法都是采用物理的方法进行检测,但是我们无法得知所抽提的RNA是否有RNA酶污染。很多人没有注意这一点,认为使用了无RNA酶实验器材,哪里还有RNA酶啊。
事实就是这么悲惨!小编甚至认为这是相关试验失败的重要原因。毕竟,很少有人会意识并且验证这一点。
RNA酶比较顽强,单纯加温也很难灭活,必须使用DEPC。实验室环境中其实存在很多RNA酶,这些酶大多来源于人的呼吸和唾沫。你可以保证自己带口罩实验,但是你可能很难要求同处一室的其他人都带上口罩。很多高质量的实验室会开通PCR专用实验间,他们的实验往往比较顺利。
RNA保温实验原理:
很简单,就是取一点样品,人为的升温并保持一段时间,接着通过琼脂糖跑胶的操作。如果存在RNA酶,那么RNA条带的28S和18S肯定模糊不清,而5S会发亮,并且条带拖尾现象严重。
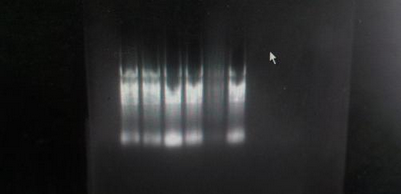
网上有一份RNA保温试验方法,还是比较好的。贴上来给大家看看。
pH7.0的Tris缓冲液补充到10ul的总体积,然后密闭管盖。把其中一份放入70℃的恒温水浴中,保温1h。另一份放置在-20℃冰箱中保存1h。时间到了之后,取出两份样本进行电泳。电泳完成后,比较两者的电泳条带。如果两者的条带一致或者无明显差别,则说明RNA溶液中没有残留的RNA酶污染,RNA的质量很好。相反的,如果70℃保温的样本有明显的降解,则说明RNA溶液中有RNA酶污染。”














