近年来,以免疫细胞为基础的肿瘤治疗方法在临床上得到了广泛的应用。随着细胞工程的发展,嵌合抗原受体(CAR)T细胞疗法在治疗血液肿瘤方面取得了巨大的成功。然而,基于T细胞的免疫疗法有一定的局限性,包括对自体细胞来源的限制,以避免人类白细胞抗原(HLA)不匹配引起的严重副作用。这种个性化治疗的必要性不可避免地导致了巨大的制造和时间成本,降低了许多患者的可及性。作为一种替代策略,自然杀伤(NK)细胞已经成为改进基于细胞的免疫疗法的潜在候选者。NK细胞能够直接杀死癌细胞,而不需要HLA配型。此外,基于NK细胞的疗法可以使用不同的同种异体细胞来源,这使得“现成”免疫疗法成为可能,副作用减少,生产时间缩短。
目前基于NK细胞的免疫疗法也存在一些限制,需要加以解决以实现广泛的临床转化。首先,对于长期的治疗方案,需要提高NK细胞在体内的持久性。其次,提高基因工程抗原受体的持续时间和稳定性对于产生强有力的治疗反应至关重要。第三,需要开发更有效、更安全的NK细胞工程系统,以取代广泛使用的病毒转导策略,以实现更高的转导效率,并提高修饰后的NK细胞活性。为了解决这些局限性,人们研究了许多基因和表面工程方法来加强NK细胞的免疫治疗(图1)。对NK细胞进行基因工程的方法可以分为病毒类和非病毒类。病毒转导依赖于工程逆转录病毒载体或慢病毒载体将所需的基因结构送入细胞。非病毒转染技术包括电穿孔、CRISPR-Cas9、纳米颗粒和Trogocytosis等介导的方法。本文就NK细胞进行基因工程的方法做一个简单介绍。
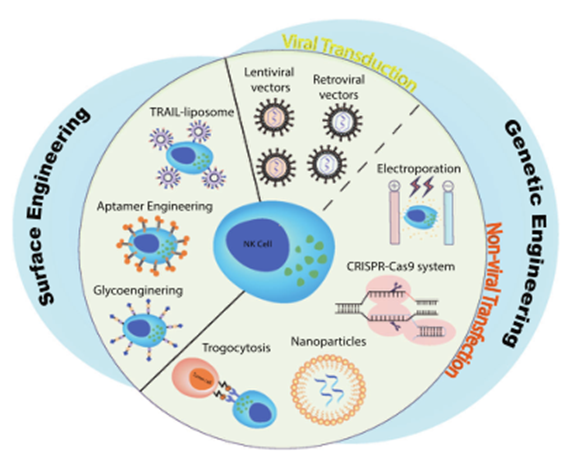
病毒转导提供了稳定的转基因的长期表达,目前基于病毒转导的NK细胞技术正在临床使用。然而,为了转染临床需求的NK细胞,需要大量的病毒,这增加了制造的复杂性和成本。此外,插入突变的潜在风险仍然是病毒载体的一个重要问题。
逆转录病毒载体
逆转录病毒载体是最早用于NK细胞工程的载体之一,通过IL-2 cDNA转导NK细胞以增强细胞在体内的持久性。然而,逆转录病毒载体在NK细胞中的转导效率较低,这可能部分归因于NK细胞对病毒载体的固有防御机制。因此,逆转录病毒转导需要快速地分裂细胞以获得最大转导效率。其他提高逆转录病毒转导效率的方法通常包括使用IL-2和K562细胞预激活NK细胞,以及多轮转导。通过这些增强策略,NK-92细胞的逆转录病毒转导效率可以从60%到90%,而这对原代NK细胞的转导效率较低,约为50%左右。
慢病毒载体
慢病毒与逆转录病毒不同,它不需要主动分裂细胞,因此能够转导更多类型的NK细胞,因此比逆转录病毒转导具有一些潜在的优势。原代NK细胞的慢病毒转导效率通常依赖于促进病毒进入的化学试剂,如阳离子聚丙稀烯和鱼精蛋白硫酸盐。然而,这些试剂已经显示出对NK-92细胞的毒性,因此替代试剂,如DEAE-葡聚糖和多聚-L-赖氨酸,近年来也被使用。此外,无毒的阳离子多肽,如维甲酸,已被用于转染造血干细胞来源的NK细胞,并显示出比化学试剂更高的转染效率。
为了减轻对病毒转导的担忧,人们已经探索和开发了用于NK细胞工程的新的非病毒传递方法。目前已知用于NK细胞基因工程的非病毒转染方法包括电穿孔、Trogocytosis介导的方法,以及几种基于纳米颗粒的递送系统,如电荷改变可释放转运体(CARTs)和脂质纳米颗粒(LNPs)。
电穿孔
电穿孔是最早和应用最广泛的非病毒转染策略之一。一个短的电脉冲作用于细胞,以产生暂时的通透性,并允许编码感兴趣基因的DNA或RNA的注入。研究表明,携带mRNA的NK细胞在质粒DNA上的电穿孔显著提高了转染效率,在静止的人原代NK细胞和体外扩增的NK细胞中的转染率都达到了80-90%。此外,Boissel 等人观察到电穿孔导致NK-92细胞转染率高于慢病毒转导。电穿孔介导的CD19和CD20-CAR-NK-92细胞对恶性淋巴细胞株的杀伤活性明显高于慢病毒载体转导的NK-92细胞。Shimasaki 等人在一项临床前研究中,报道了电穿孔的人NK细胞在对抗B细胞白血病方面的有效效果。他们还观察到,电穿孔后细胞存活率的中位数维持在90%左右,并且表达抗CD19-CAR的NK细胞与CD19+靶细胞相互作用时分泌干扰素-γ的细胞毒性增强。
除了血液癌,电穿孔NK细胞被证明对实体瘤有效。Liu等人报道了电穿孔转染编码HER2-CAR的质粒DNA的NK-92细胞治疗乳腺癌细胞的研究。结果表明,HER2-CAR-NK-92细胞在电穿孔后保持了60-90%的细胞存活率,并在小鼠乳腺癌模型中表现出明显的肿瘤组织浸润和肿瘤生长抑制。这项研究强调了电穿孔NK-92细胞治疗实体瘤的潜在临床可行性。然而,尽管电穿孔比病毒转导更安全,但有可能导致细胞死亡和对细胞膜造成不可逆转的损害,从而限制了其临床潜力。
Trogocytosis介导的方法
当淋巴细胞,如B、T和NK细胞,与抗原呈递细胞相互作用,可以通过免疫突触从这些细胞继承表面分子。研究表明,这也发生在淋巴细胞和靶细胞之间,如癌细胞。Somanchi等人通过将NK细胞与表达趋化因子受体CCR7的K562“供体”细胞系共培养,证明了Trogocytosis在工程人NK细胞以增强淋巴结归巢方面的潜力。结果表明,与K562细胞共培养1h后,80%的NK细胞表达CCR7,并促进NK细胞向淋巴结的迁移。
还探索了Trogocytosis方法作为一种非病毒传递方法将CAR结构转移到NK细胞的潜在用途。将高表达抗CD19 CARS抗体的K562“供体”细胞与PB-NK细胞共培养1h后,发现18.6%的NK细胞表达抗CD19-CAR抗体,且这些NK细胞对B-ALL细胞的杀伤活性增强。然而,Trogocytosis介导的受体转移很容易丢失。获得性蛋白的快速丢失大大限制了Trogocytosis工程NK细胞在临床上的应用。因此,进一步的研究对于提高以Trogocytosis为基础的NK细胞修饰的持久性和稳定性是至关重要的。
CRISPR-CAS9系统
簇状、规则间隔、短回文重复(CRISPR)相关蛋白9(CAS9)系统已被广泛用作靶向基因编辑的高性价比和高效率工具。CRISPR-Cas9系统通过在引导RNA的指导下由Cas9核酸酶诱导双链断裂,实现了可定制的特异性。然后,该系统插入具有非同源末端连接或同源定向修复途径的感兴趣的基因序列。Pomeroy等人的一项研究报道了CRISPR-Cas9介导的敲除关键抑制信号分子ADAM17和PDCD1以改善PB-NK细胞功能的概念验证结果。该方法有效地修饰了90%的PB-NK细胞,增加了免疫抑制剂TME的细胞因子产生和肿瘤细胞毒性。此外,该研究小组还将编辑的PB-NK细胞扩大到临床需求的细胞数量,而不损失细胞活性,证明了CRISPR-Cas9工程NK细胞的临床潜力。
电荷改变可释放转运体(CARTs)
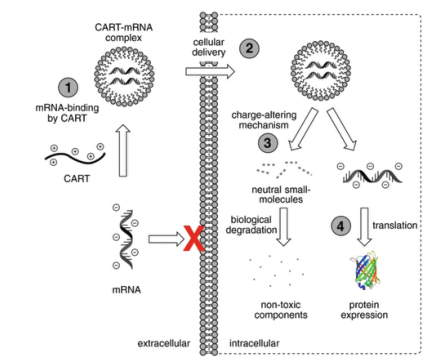
McKinlay 等人报道了一种用于将mRNA递送到免疫细胞的新递送系统,称为电荷改变可释放转运体(CARTs)。具体地说,CARTs最初充当阳离子,以非共价方式络合、保护并向免疫细胞运送mRNA。一旦进入细胞膜,CARTs就会经历生物降解,并分解成小的、无毒的、中性的分子,释放功能性mRNA来诱导蛋白质表达(图2)。
脂质纳米颗粒(LNPs)
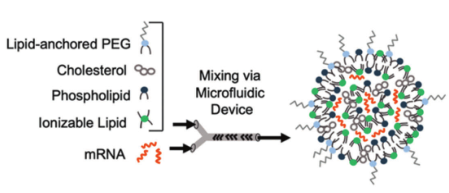
为了介导核酸的胞浆递送以调节基因表达,脂质纳米颗粒(LNPs)已被开发为一种非病毒递送系统,它能够保护核酸货物不被核酸酶降解,并介导内体逃逸。LNPs由一种可电离的脂质成分组成,它在生理pH下带中性电荷,在酸性的内质体室中带正电荷,从而允许货物释放到胞浆中。除了可电离脂质,LNPs通常由三种额外辅料组合而成:用于改善稳定性和增强膜融合的胆固醇成分,用于帮助体内逃逸和包裹货物的辅助磷脂成分,以及用于最小化LNP聚集的脂质锚定聚乙二醇结合物(图3)。一些研究已经研究了LNPs在转染各种免疫细胞中的使用。Billingsley等人报道了使用可电离LNPs利用mRNA产生人CAR-T细胞。该方法通过LNPs将CAR mRNA传递到人类T细胞,诱导瞬时CAR表达。这种方法显示了与传统电穿孔技术相当的转染效率,但细胞存活率显著提高,体外抗肿瘤细胞毒性增强。根据LNP介导的CAR T细胞的设计理念,可以设计类似的LNP系统来设计用于癌症免疫治疗的CAR-NK细胞。
近年来,用于癌症免疫治疗的重定向或增强NK细胞细胞毒作用的基因工程策略正在迅速发展,并引起了越来越多的关注。越来越多的证据证明了工程NK细胞治疗各种癌症的安全性和有效性。近年来,随着药物输送和基因编辑系统的快速发展,CRISPR-Cas9技术和纳米颗粒输送系统都是非常有前途的领域,有可能在不久的将来迅速推进基于NK细胞的癌症免疫治疗。
1.Delivery technologies to engineer natural killer cells for cancer immunotherapy.
2.Genetic manipulation of NK cells for cancer immunotherapy: Techniques and clinical implications.
3.A genetically engineered primary human natural killer cell platform for cancer immunotherapy.
4.Charge-altering releasable transporters (CARTs) for the delivery and release of mRNA in living animals.














