免疫组化实验操作
2022-11-04
分类:
实验干货
阅读(1204)
收藏
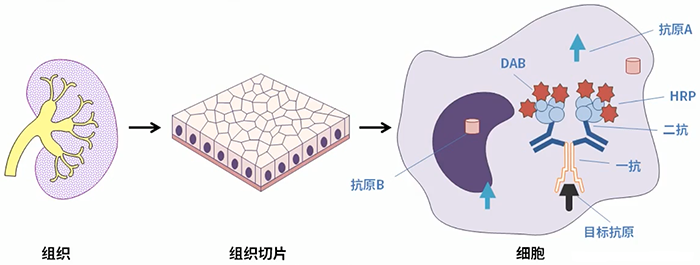
- 免疫组化( Immunohistochemistry, IHC)
- 棕色越深,目标蛋白含量越高,通过软件分析,即可量化目标蛋白的含量。
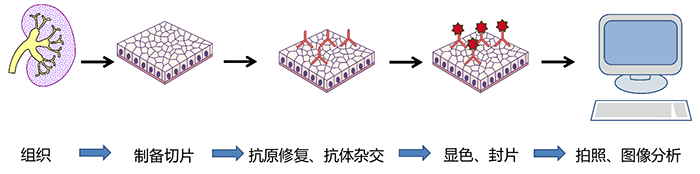
- 组织块制备成组织切片。需要用固定液固定组织,常用多聚甲醛、福尔马林、波恩固定液。
- 抗原修复、抗体杂交。固定液中含丰富醛基,能与蛋白质中的氨基交联,从而掩盖一些抗原表位,抗体无法结合,所以在抗体孵育杂交之前要做抗原修复。
- 显色、封片。一抗、二抗杂交完成后,使用 DAB 显色,盖玻片盖片。
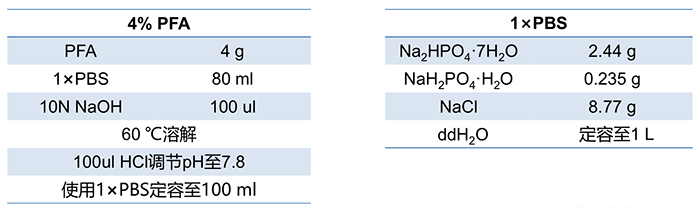
◆ 新鲜取材的组织,将组织切成直径不超过 5mm 的小块,4%多聚甲醛 PFA 固定液(PBS 配制,4℃预冷),4℃固定过夜;PBS 洗 3 次,每次 5 min。◆ 组织越新鲜越好,最好一取下就放入预冷的固定液中;如果组织暴露在空气中一段时间,组织缺水,最后组织形态就会不好看。4% PFA 可在适当分装后冻存在-20℃。(最好不要放在 4℃或室温,容易解聚,影响固定效果。固定液推荐用 PFA,最好不用福尔马林)(2)脱水透明 (低浓度到高浓度的乙醇逐级脱水,组织块小的可以缩短脱水时间)③ 70%乙醇,30-60 min(可 4℃过夜)⑥ 100%乙醇,30 min (不要随意增加脱水时间,防止脱水过度)⑧ 二甲苯 透明,10 min × 2 次 (10 min 时更换一次新鲜二甲苯,用二甲苯置换组织中的乙醇,组织会变得透明化。如果前面脱水不充分,二甲苯会变浑浊。)◆ 注意:脱水时,把组织块放中带盖子的玻璃瓶中,在摇床上轻轻摇动,混合液体促进脱水;拧紧盖子,防止乙醇吸收空气中的水分。◆ 梯度酒精可重复使用,按 1ml 乙醇溶液处理一个组织计算,配制 100ml 50%乙醇就可以处理 100 个组织,在试剂瓶上贴标签,画正字做标记,重复使用到差不多次数时就该换新的酒精溶液了。◆ 1mm 的组织块二甲苯透明后会玻璃化;直径大些的组织块,二甲苯透明后,边缘玻璃化,中间雾蒙蒙时就已经算透明完成了,如果持续在二甲苯中待着,组织会变脆,切片时就容易切碎。二甲苯是挥发性液体,强致癌,需要戴口罩,在通风橱中操作。◆ 原理:石蜡中 56℃时可以保持液体状态,把组织放入液体石蜡,让石蜡慢慢渗透进组织间隙;当温度降下来,石蜡凝固, 组织就能在石蜡的支撑下变硬,从而能被切成薄薄的切片,并保持原本的细胞结构。① 石蜡,56℃,2h(省掉了二甲苯和石蜡 1:1,因为高温下二甲苯会让组织更容易变脆)② 石蜡,56℃,2h (浸蜡 2h 后换一道新鲜蜡再浸一次,消除二甲苯的影响)③ 制作包埋块 。使用新鲜化开的头道蜡,把蜡在 56℃融化后搅匀,用玻璃吸管将液体蜡加满金属托(如下图,中),再把浸泡在液体蜡中的组织块放入金属托,用预热的金属镊子调整组织块的切面,盖上塑料盖(作为切片时的样品托),补加蜡液淹没塑料盖,使塑料盖和组织切片形成一个整体(方便样品托要固定在切片机上)。包埋的组织块放室温,自然冷却凝固。为方便脱模,可以放入-20℃冻一会儿(冻久了蜡块容易裂)。① 修块。修出一个组织块在中心的正方型或长方形的切面,四个角尽量是直角,这样切出来的切片正,不容易打卷。② 切片:将蜡块固定在切片机上,切成薄片(5-8um)。切到组织部分时,稍微放慢进刀速度,切好的蜡片会形成一条连续的蜡带,切到一定长度就用毛病拖着轻轻转移到旁边准备好的托盘里(托盘里铺一层黑色的衬底,有种黑色的塑料袋,上面有很多突起,可以很好的隔开蜡片,免得蜡片完全贴中塑料袋上)。③ 展片和贴片:切下的薄片往往皱折,要将之轻轻飘浮在 37℃-42℃热水中 充分展开。转移进托盘的蜡带,可以 2 个组织一组,用手术刀分割一下,然后用镊子轻轻夹到 40℃水浴中展片和贴片,贴片时,载玻片在蜡片旁边竖着插进水里,再竖着提起来,蜡片就能贴在载玻片上。④ 充分干燥:贴片后的载玻片先斜靠着晾干,利用重力赶走蜡片和载玻片之间的水,再收到片盒里,放到 37℃ 恒温箱烤片 3 天。① 脱蜡:60 ℃ 烤 1h (切片上的蜡液融化) → 二甲苯 5 min → 二甲苯 5 min;◆ 切片分别在二甲苯中 2 次以脱掉组织中的石蜡,使组织恢复到固定后的正常状态暴露出抗原以方便与一抗结合。若脱蜡和水化不全易出现局灶性反应和浸洗不全,而产生非特异性背景着色。脱蜡的效果主要是取决于切片的厚度、二甲苯的温度、脱蜡时间,或移入恒温箱加热脱蜡。② 水化:梯度酒精各 5 分钟(高浓度到低浓度)。无水乙醇 5 min → 无水乙醇 5 min → 95%乙醇 5 min → 85%乙醇 5 min →75%乙醇 5 min → 50%乙醇 5 min;◆ 水化的目的是洗去溶解的石蜡和二甲苯。二甲苯属于非水溶液的有机溶剂,进入组织中的二甲苯不能与水溶性染色液相溶,需要通过梯度乙醇把组织中的二甲苯逐步替换出来,使标本切片从无水状态顺利进入染色液中进行染色反应。◆ 抗原修复是指暴露抗原被封闭或隐藏的表位,恢复其原有的空间状态,提高抗原阳性检出率的过程。由于组织在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而掩盖抗原决定通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。① 非加热修复:酶消化。胰蛋白酶(修复能力较弱,主要用于细胞内抗原的修复,使用 0.1%氯化钙(pH 7.6)制成 0.05%-0.1%胰酶液,37℃孵育切片 15-30 分钟,陈片应当适当延长时间)、胃蛋白酶(修复能力较强,可用于细胞间抗原的修复)、链霉蛋白酶、蛋白酶 K、皂素。总的来说,非加热修复能力较弱,一些位于细胞间质的抗原可以用酶消化法。② 加热修复(3 选 1):更推荐加热的修复方式,效果好,且稳定。◆ 煮沸修复(加热修复中效果最弱):电磁炉煮沸修复液 → 放入切片→ 持续沸腾 15-20 min,自然冷却 。石蜡切片脱蜡至水后,一片片放在耐高温的片夹上,放入盛有修复液的容器(如盛有足够柠檬酸修复液的玻璃烧杯),并将容器放入装满水的电锅里加热煮沸,从沸腾开始计时 15-20min,切断电源,室温冷却,PBS 洗,之后就可以进行免疫组化染色。◆ 微波修复:微波炉煮沸修复液→ 放入切片→ 高火 5 min,冷却 10 min,重复 2-3 次,自然冷却 。微波炉加热煮沸柠檬酸修复液(耐高温的玻璃烧杯盛放修复液),沸腾时,将脱蜡至水的切片放在有机玻璃架上,放入修复液中(也有专用于微波修复的塑料盒,其中装柠檬酸修复液,把切片垂直插在盒中) 。按上述步骤加热修复后(有的抗体不好做,做 3 次加热重复可能会有改善),室温自然冷却,冷却过程中不要把切片从缓冲液中取出。修复完成后,PBS 洗 3 次,再进行后续的免疫组化染色。◆ 高压修复:高压锅煮沸修复液→ 放入切片→ 高压锅开始喷气时计时 1-2 min,冷水冲淋冷却 。切片脱蜡至水后,使用高压锅加热沸腾修复液,将切片放在金属架上,放入沸腾的修复液中(尽量使用过量的抗原修复液,防止高温液体挥发干涸,对切片造成不可逆的损伤),高压锅开始喷气时计时 1-2min,关闭加热源,用冷水冲淋高压锅至室温,取下气阀,打开锅盖,取出切片,PBS 洗 3 次,再进行后续的免疫组化染色。◆ 常用的修复方法从强到弱一般分为三种:高压加热修复、微波修复、胰酶修复。其中高压加热修复这一方法简便易操作,效果也更好。有的抗原用一种修复方法可能达不到理想效果,可以考虑酶消化法和高温修复法联用。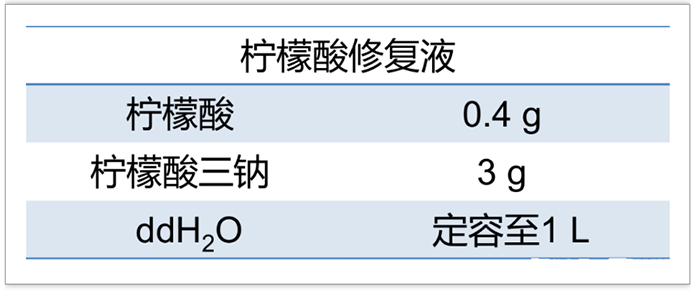
(1)灭活内源性过氧化物酶(上抗体之前选做的步骤):3% H2O2(1ml 30%双氧水 + 9ml 甲醇,用甲醇配制过氧化氢更适合于保护抗原和固定组织) ,室温孵育切片 10 min,PBS 洗 3 次,每次 5 min。◆ 在传统的亲和素-生物素-过氧化物酶复合物法(ABC 法)和链霉亲和素-过氧化物酶法(SP 法)中,免疫组化反应容易受到内源性过氧化物酶和生物素的干扰,必须用过氧化氢和卵白素等进行灭活和封闭。(2)封闭:10%羊血清,湿盒中室温 1h 或 4 ℃ 过夜。(与免疫荧光技术一样,使用 10%与第二抗体同种属的正常血清进行封闭,是为了防止一抗与组织的非特异性结合,造成假阳性。)(3)一抗孵育:去封闭剂,阻水笔画框将组织片框起来,每个组织上滴加 50ul 抗体,湿盒中 4 ℃ 过夜后,第二天 37 ℃ 1h。吸去一抗,PBS 洗 4 次,每次 5min。◆ 不同的一抗浓度根据抗体说明书而定,孵育时间和温度等对染色结果往往有着较大的影响。在 4℃下,反应缓慢,背景较浅,推荐使用。◆ PBS 洗涤是为了去除未反应的抗体和其他杂物,以减少非特异性反应引起的背景着色和杂物污染,因此应该充分洗涤,特别是一抗孵育后。一般使用 PBS 洗涤 3 次,每次 5 分钟。(4)二抗孵育:加二抗,每个组织上滴加 50ul 抗体,湿盒中 37 ℃ 孵育 30min。吸去二抗,PBS 洗 8-12 次,每次 5min(尽量洗掉非特异的结合)。(1)显色:新鲜配制 DAB 显色液(现配现用),每个组织滴加 50ul,显微镜下控制显色,只上了二抗没上一抗的对照没有出现棕色,而目的组织颜色反应明显时,将片子插到 PBS 里终止显色。◆ DAB 显色液(3,3’-二氨基联苯胺)终产物为棕黄色或棕褐色,为免疫组化最常见的的显色液。DAB 显色的棕黄色色原稳定性好,不溶于有机溶剂,可长期保存而不褪色。背景的深浅和特异性染色的深浅都可以由 DAB 孵育条件决定。DAB 显色时间不是固定的,主要由显微镜下控制显色时间,到出现特异性染色较强而背景着色较浅时即可冲洗。◆ DAB 显色时间很短(如几秒或几十秒)就立即出现很深的棕褐色,这可能说明一抗浓度过高,需要适当下调抗体浓度;若很短时间就出现深背景,有可能非特异性蛋白封闭不全,需要延长封闭时间;DAB 显色时间很长(如超过 10 分钟)才出现阳性染色,可能是一抗体浓度过低或者封闭时间过长。(2)苏木素复染:显色完毕的片子放入苏木素染液(染细胞核)室温染色(不同牌子的苏木素染色时间不同,见说明书)后自来水冲洗 20-30min,显微镜下随时观察显色情况(够蓝就可以终止了)。(3)脱水:95%乙醇 2-3s → 95%乙醇 2-3s → 100%乙醇 5 min → 二甲苯 : 无水乙醇 1:1 5min → 二甲苯 2min → 二甲苯 2 min。封片技巧:(如图)把准备好的盖玻片正面朝上、反面朝下放着,用小吸管画一长条树胶,然后把染色完毕带有组织的载玻片正面朝下、反面朝上倒扣到盖玻片上。
- 拍照前要注意把显微镜输出图片的格式调成 TIFF 格式,像素尽可能的高。
- 带标尺和不带标尺的照片都要拍摄(各拍一套,有时候软件自带的标尺不好看,作图时按带标尺的照片用 PS 给不带标尺的照片加标尺)