今天我们将了解,如何进行培养MSC,培养的过程中需要注意哪些事项?
接下来跟随我们一起做实验吧~
利用间充质干细胞无血清培养基培养分离脐带间充质干细胞。 新生儿脐带 医用手术器械,生物安全柜,CO2培养箱,6孔培养板,T25培养瓶 1. 冻存的MSC NutriStem® XF Supplement在室温或2-8℃解冻,避免反复冻融。 2. 配制:MSC NutriStem® XF Basal Medium(培养基):MSC NutriStem® XF Supplement(添加物):青链双抗=500ml:3ml:5ml,4℃保存,2周内使用。 注1:双抗非必须,建议原代(P0)时使用。 注2:培养基含L-Glutamine,贮藏时避免长期照光。
或跳过此步骤,直接加2%血小板裂解物,促进MSC细胞贴壁与生长。
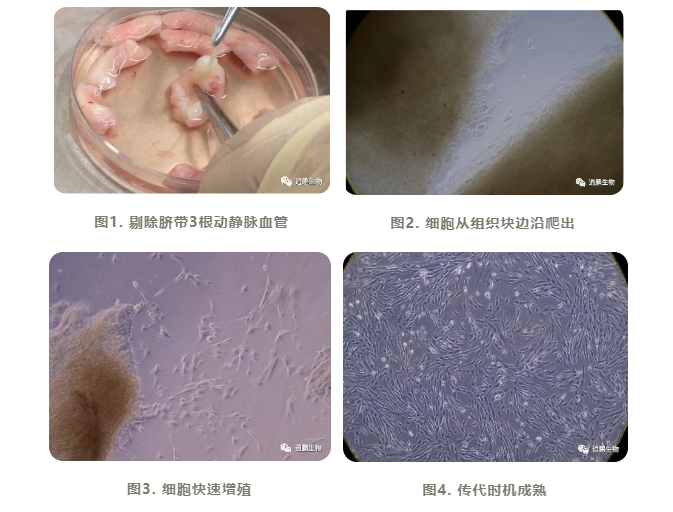
使用无菌的DPBS,将50X大豆胰酶抑制剂稀释成1X。 注1:抑制重组胰酶消化建议方法: 第一种使用大豆胰酶抑制剂; 第二种使用PBS/DPBS清洗(2倍重组胰酶量)吹打, 离心去上清;第三种使用维持培养基抑制。 无血清培养基抑制胰酶效果较差,使用无血清培养基时建议用第一或者第二种方法抑制/清除胰酶。 1. 无菌条件下取新鲜脐带,用DPBS漂洗净血迹。 注1:一般脐带取得非无菌环境,可以稍微用75%酒精润洗。 2. 置10 cm于培养皿中,剪成1~2cm脐段,剔除血管,用DPBS洗净血迹,再剪成1 mm3组织块。(图1) 3. 用无菌滴管吸取少量细小组织块均匀散布在 6 孔板 2 个孔中。 4. 37℃,5%CO2培养箱孵育30min,以使组织块粘贴在培养皿壁上。 5. 向每孔滴加0.8 ml 完全培养基(注意沿孔壁小心滴加,勿使冲动组织块) 。 6. 37℃,5% CO2 培养箱孵育过夜,次日(D1)每孔再补加1 ml 完全培养基。 7. 37℃,5% CO2 继续培养,5天(D6)后半量换液(此时一般看不到细胞,但最快3天就可看到细胞从组织边沿爬出)。 8. 再过5天后半量换液(此时一般会有细胞爬出,但最晚可到14天会出现细胞从组织边沿爬出)(图2、图3)。 9. 每2天换一次培养液,继续培养2~4天,待细胞融度(Confluency)达到约80%后传代培养(图4)。 注1:组织块培养的关键是要保障组织块始终贴壁,换液动作要尽可能轻微,避免冲动组织块。培养基加量不能太多,以免组织块漂浮。 UC-MSC原代培养 (消化法) MSC NutriStem®无血清培养基能有效地培养消化法获得原代细胞,操作方式参考如下: 1. 将脐带用DPBS+1%青链双抗漂洗3~5次,剪成 1-2 cm大小,剔除两根动脉血管和一根静脉血管,获得华通氏胶,同时称重。 2. 将组织块剪成 3-5 mm3,移入50 ml 离心管,再加入相应比例的分离液。 3. 组织块(华通氏胶g): (分离液vol)= 1:3(1g:3ml),在分离液中添加1%青链双抗。 4. 把 50 ml 离心管横放于 37 ℃细胞培养箱,静置16小时。(若使用旋转法,则置于37 ℃细胞培养箱中旋转4 h,转速为10 rpm。) 5. 消化反应结束之前,预先在6孔板中加入1ml完全培养基(NutriStem XF Basal Medium+5%PLTGold),置于37℃细胞培养箱中孵育1小时,达到预包被的效果。 6. 加入和分离液等体积的0.05%EDTA 终止反应后,将样品转移至15ml离心管中,1200xg 离心5分钟,离心时调至最慢降速(有刹车),去除上清,溶液比较浓稠,小心不要影响下层的细胞;建议留下 2 ml 左右的溶液。 7. 以和分离液等体积的DPBS+1%青链双抗重悬细胞后,500 xg 离心 5 分钟,离心时调至最慢降速(有刹车),小心去除上清,不要影响下层的细胞;建议留下 1.5 ml左右的溶液。重复本步骤操作3次。 8. 用适量的培养基重悬细胞后(重悬后细胞悬液总体积为3 ml),计数细胞密度,即可按常规细胞培养方法接种原代细胞培养。(原代细胞推荐用NutriStem XF Basal Medium+5%PLTGold培养) 注:消化后的原代细胞,建议培养时接种密度提高10000/cm2以上;传代后即可按常规的接种密度(5000~6000/cm2)培养。 UC-MSC传代培养与冻存