麻醉是动物实验中一项基本的必备技能,然而我们常常会遇到很多问题:如在麻醉过程中,小鼠发生死亡或者实验还没结束,小鼠就苏醒了。这既影响了实验进度,也会让动物饱受痛苦。追根溯源,这其实和我们实验中麻醉剂的选择及给药剂量有很大关系。
麻醉:在一些动物实验,特别是手术等实验,为减轻其实验过程中的疼痛和不适感觉,保障实验动物的安全,利用物理或化学的方法,使动物的全身或局部暂时失去痛觉或痛觉迟钝,减少动物的挣扎和保持安静。既符合动物福利,又能够保证实验顺利进行
良好、稳定、低死亡率的麻醉是动物实验必不可少的环节。由于麻醉药品的作用特点不同,动物的药物耐受性有种属或个体间差异及实验内容及要求不同,因此正确选择麻醉药品的种类、用药剂量及给药途径十分重要。理想的麻醉应该既要保证实验操作顺利进行,保证获得的实验数据准确可靠,又要将实验动物遭受的痛苦降至最低,保证动物福利要求。
根据麻醉范围主要分为全身麻醉和局部麻醉,全身麻醉又分为吸入麻醉和非吸入麻醉。
1. 全身麻醉:实验动物一般较难合作,因此,实验中常采用全身麻醉。
2. 局部麻醉:指通过麻醉药阻断机体某一部分的感觉神经传导功能,而运动神经传导保持完好或同时有程度不等的被阻滞状态。
下面详细介绍:
01 吸入式麻醉
吸入式麻醉通常适用于麻醉时间较短的动物实验,或用作基础麻醉,或注射麻醉的辅助麻醉。起效快,麻醉效果稳定,且动物苏醒快,且麻醉的深度和维持时间易控制,被认为是啮齿类动物最可靠的麻醉方式。
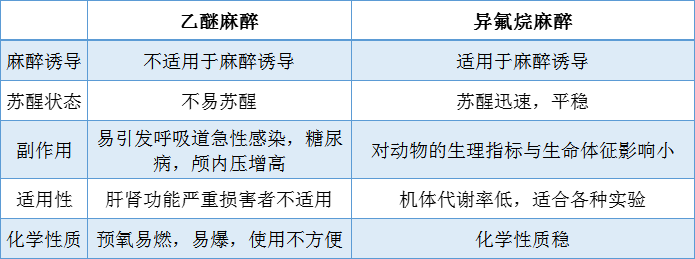
我们下面主要介绍2种常见的麻醉剂——乙醚和异氟烷。
1. 乙醚
特点:操作简单,见效快。乙醚为高度易挥发性液体,被吸收后会广泛抑制中枢神经系统。其麻醉量和致死量差距大,所发安全度亦大,动物麻醉深度容易掌握,而且麻后苏醒较快。
缺点:对局部刺激作用大,可引起上呼吸道粘膜液体分泌增多,再通过神经反射可影响呼吸、血压和心跳活动,并且容易引起窒息(若麻醉过深,可导致动物死亡),故在乙醚吸入麻醚时必须有人照看,以防麻醉过深而出现上情况。由于其会对实验动物有害,且可能造成的操作人员危险等原因,目前使用相对较少。
注意:由于乙醚燃点很低,遇火极易燃烧,所以在使用时,一定要远离火源。
适用实验:乙醚吸入麻醉适用于各种动物,由于起效和维持时间短,本法最适于大、小鼠的短期操作性实验的麻醉,如大鼠眼眶取血等简单实验。
操作方式: (1)大鼠、小鼠、豚鼠的吸入麻醉:吸入麻醉一般需借助麻醉罐进行,常用的麻醉罐大多为透明带盖的容器,大小根据动物体积而定。将被乙醚浸湿的消毒脱脂棉球或纱布放入麻醉罐,将把待麻醉动物入,盖上盖,观察动物的行为。会发现动物即刻出现兴奋、继而出现抑制,随即自行倒下。当动物角膜反射迟钝、肌肉紧张度降低时,即可取出动物。 若实验时间过长,可准备一个蘸有乙醚的棉球小烧杯,在动物麻醚变浅时给套在鼻上使其补吸麻药。 (2)家兔、猫的吸入麻醉:麻醉方法基本同大鼠、小鼠。将动物投入麻醉罐中1-2min,从动物后腿依次出现麻痹现象,随后失去运动能力,这表明动物已进入麻醉状态,4-6min可将动物麻醉。当发现动物倾斜后仍不能站立,则说明已进入深度麻醉期,需立刻取出动物。
2. 异氟烷 (Isoflurane)
特点:异氟烷是目前广泛使用的吸入麻醉药,是无色透明的液体,不易燃烧,易挥发,具有轻微气味;诱导和复苏均较快,加上不会影响动物的生理指标,在动物实验中的应用日趋广泛。
异氟烷气体吸入式麻醉也是目前国际惯用的麻醉方式,成果易得到国际承认。
适用实验:几乎适用于所有实验,尤其需长时监测的实验。研究表明,异氟烷麻醉能维持动物的心率、血氧分压、血液pH等生理功能处于稳定状态,适合情况复杂且持续时间较长的动物实验,包括连续监测动物参数变化如成像技术、还有一些其他全麻药不宜使用的疾病,例如癫痫、颅内压增高、重症肌无力、糖尿病等。
操作方式:一般使用时会配专用的吸入麻醉机(现在越来越多的实验室拥有气体麻醉装置了),混合纯氧进行麻醉,通过氧气气流使异氟烷挥发,诱导麻醉一般使用2-3%的浓度,维持使用1.5-2%。一般在麻醉机连接一个麻醉罐子,如果单独维持麻醉操作就使用面罩比较合适。一般小鼠的麻醉时间为2-3min,大鼠的麻醉时间为4-5min。
02 注射式麻醉
注射麻醉是使用非挥发性全身麻醉药进行麻醉的方法。大小鼠实验中常用苯巴比妥钠、戊巴比妥钠、水合氯醛和氯胺酮等麻醉剂,这些麻醉剂使用方便,一次给药可维持较长的麻醉时间,麻醉过程较平衡,动物无明显挣扎现象,但缺点是苏醒较慢。
一般采用静脉注射、腹腔注射、肌内注射等方法进行麻醉。兔、猫、犬、猪等大动物常采用静脉注射、肌内注射的方法进行麻醉;小鼠、大鼠、豚鼠等小动物常采用腹腔注射(注射部位宜选在腹部后1/3处略靠外侧,避开肝和膀胱)的方法。
注射麻醉因其操作简便,又能使动物很快进入麻醉期,麻醉时间较长,成本低的特点,目前在国内广泛使用。
注射麻醉法麻醉时,给予麻醉药后,动物即倒下,全身无力,反应消失,表明已达到适宜的麻醉效果,是进行手术的最佳时期。
在麻醉兴奋期出现时,动物挣扎不安,为防止注射针滑脱,常用吸入麻醉法进行诱导,待动物安静后再行腹腔或静脉穿刺给药麻醉。在注射药物时,先用总量的三分之二,密切观察动物生命体征的变化,如已达到所需麻醉的程度,余下的药物则不用,避免动物死亡。 若动物四肢开始抖动,表明接近苏醒。若手术尚未完成,需及时将含有乙醚等挥发性麻醉药的麻醉瓶放在动物口、鼻处,给予辅助吸入麻醉,直至手术完成。若实验过程中,动物发生抽搐等症状,说明麻醉过深,可能是死亡的前兆,需立刻进行急救处理。
不同麻醉剂有不同的药理作用和副作用,应根据实验要求和动物种类而加以选择,使用适合。下表列举了一些常用注射麻醉药物及其特点:
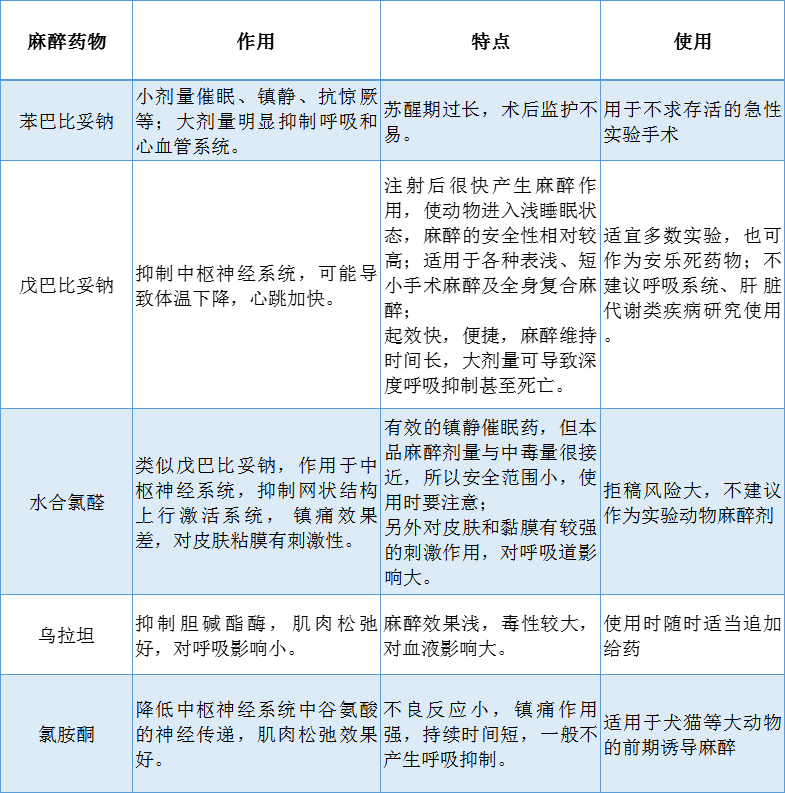
(其中水合氯醛这种麻醉剂近年来产生了一定争议。由于存在麻醉效果差、刺激性强、毒副作用大、有悖实验动物福利原理等原因,国外期刊普遍建议不再使用其作为实验动物麻醉剂。)
由于麻醉药物的作用特点不同,不同种属的动物对药物耐受不同,实验研究方向不同,所以在腹腔和静脉麻醉时,一定控制药物的浓度和注射量(见下表)。
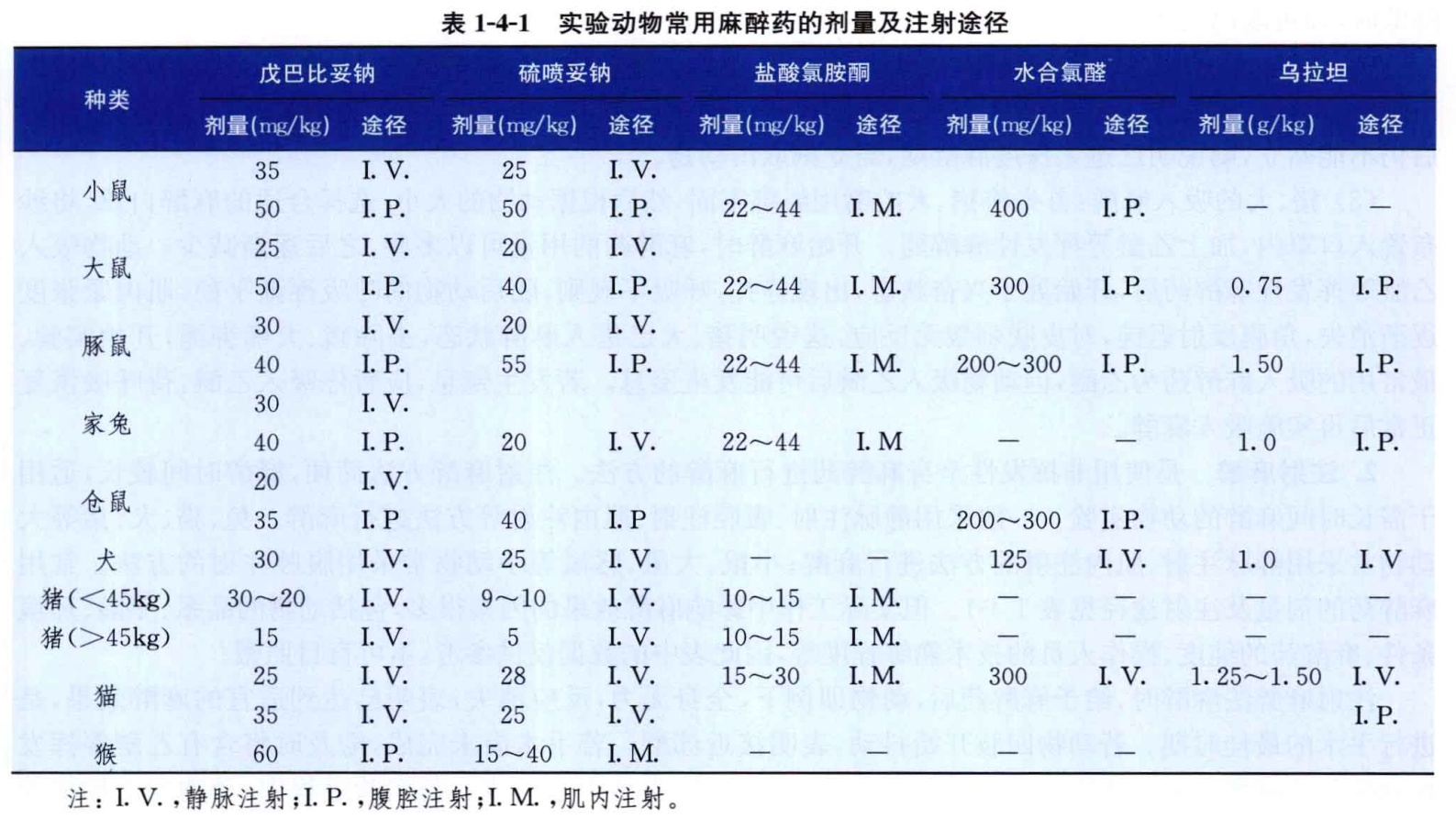
表格来自中日友好中医院病理主任潘林老师编写的《实验病理学技术图鉴》,表格中基本囊括了常用的麻醉药种类、注射剂量等。
麻醉剂的用量除参照一般标准外,还应考虑个体对药物的耐受性不同,而且体重与所需剂量的关系也并不是绝对成正比的。动物的健康、体质、年龄、性别也影响给药剂量和麻醉效果。一般说,衰弱和过胖的动物,其单位体重所需剂量较小。动物实验批次差异实在太大,并且同种麻醉药不同纯度,其麻醉效果往往差别较大,需考虑麻醉药的纯度问题。(故文献等资料提供的剂量仅供参考,切记不可盲目照搬。有条件最好做预实验,从而确定麻醉剂量。)
注意事项: (1)静脉注射必须缓慢,同时观察肌肉紧张性、角膜反射和对皮肤夹捏的反应,当这些活动明显减弱或消失时,立即停止注射。配制的药液浓度要适中,不可过高,以免麻醉过急;但也不能过低,以减少注入溶液的体积。 (2)在使用麻醉药过程中,随时注意观察动物的反应,尤其是采用静脉注射时,绝不可将按体重计算出的用量匆忙进行注射。 (3)腹腔注射最主要的就是要针头进入动物腹腔后,一定要注意回抽,否则极易将麻药打到动物的胃肠道,引起胃肠道麻痹胀气,动物常因此无法进入麻醉状态,甚至死亡。 静脉注射一般采用鼠尾静脉或兔耳缘静脉注射。正确找到注射的静脉是很关键的。其次就是,当采用体重计算麻药用量后,切不可匆忙注射,静脉注射必须缓慢进行,一定要边注射边观察动物的反应,如肌肉紧张度、角膜反应、抓捏反应等。
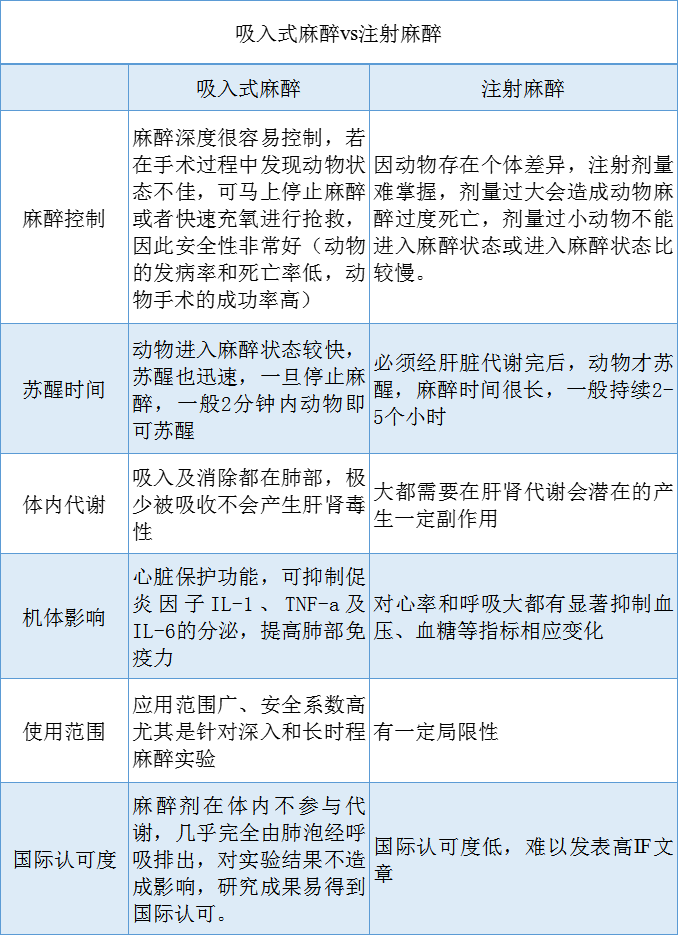
吸入式麻醉和注射式麻醉如何选择?
吸入麻醉的优缺点:较好地控制麻醉深度,快速进入麻醉状态,苏醒迅速、平稳,对肝、肾功能影响轻微;但挥发性麻醉药被人体长期吸入后会对医护人员造成身体上的伤害,且每种挥发性麻醉药的挥发罐的价格昂贵。
非吸入麻醉的优缺点:操作简便,无需特殊的麻醉装置,与吸入麻醉相比成本较低。但不能灵活掌握用药的剂量、麻醉深度以及麻醉维持时间,且麻醉药物需要通过肝脏代谢,肾脏排出,因此相比之下对肝脏和肾脏的影响较大。
03 局部麻醉
局部麻醉是用局部麻醉药阻滞周围神经末梢或神经干、神经节、神经丛的冲动传导,产生局限性麻醉区。局部麻醉的特点是动物可保持清醒状态,对重要器官功能干扰轻微,麻醉并发症少,是一种比较安全的麻醉方法。
目前常用的局部麻醉剂有普鲁卡因、利多卡因和丁卡因。如下为这三类的比较:
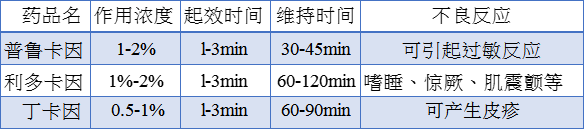
局部麻醉常用的方法是表面麻醉、浸润麻醉、区域阻滞麻醉及传导麻醉等。
表面麻醉:将穿透力强的局部麻醉药直接作用于黏膜表面,使黏膜下神经末梢麻醉。可将药物配成不同浓度的溶液、凝胶和糊剂,通过滴入、喷雾、涂布和灌注等方法将其应用到眼、口腔、鼻腔、喉、外耳道或尿道等黏膜处,产生麻醉。 浸润麻醉和区域阻滞麻醉:沿手术切口线逐层注射局部麻醉药或手术区周围部位注射药物,阻滞神经纤维而达到麻醉作用,前者称为浸润麻醉,后者称为区域麻醉。适用于犬、猫皮肤撕裂窗缝合、皮肤疣及皮肤肿瘤的切除、幼犬截尾术和皮肤活组织的采集等。
注:局麻一般采用浸润麻醉方法,操作时,动物固定好后,首先在局部皮肤用皮头针先作皮内注射,形成橘皮样丘疹,然后换成局部麻醉长针头,由皮点进针,放射到皮点周围继续注射,直到要求麻醉区域的皮肤都浸润为止;可以根据实验操作要求的深度按照皮下、筋膜、肌肉、腹膜或骨膜的顺序,依次注射麻药,以达到麻醉神经末梢的目的。
局部麻醉虽然在动物实验中用途不是很广泛,但猫、犬等大动物在短时间的实验中可能会使用局部麻醉的方法。
麻醉过程中常遇到的问题:
1、麻醉时需要注意什么?
(1)保温 动物在麻醉期间体温易下降,可将动物置于循环水恒温垫上进行保温。 麻醉期间,动物的体温调节机能往往受到抑制,出现体温下降,可影响实验的准确性。既往,很多人没能重视体温对于动物的重要性,动物在麻醉后、手术中、手术后的体温与动物死亡率密切相关。在寒冷冬季,麻醉剂在注射前应加热至动物体温水平。动物的麻醉期尚未过时,要注意动物的保暖(37℃)。 保温的方法有,实验桌内装灯,电褥,台灯照射等(在撰写文章时,将这些内容写进去,会给编辑留下较好的印象。)。无论用哪种方法加温都应根据动物的肛门体温而定。(动物正常的肛门温度参考值:大鼠37.5℃,小鼠37.5℃,家兔39.5℃,豚鼠39.5℃,狗38.5℃,猪39.0℃,羊39.5℃,猴39.0℃)。 (2)观察 使用麻醉剂过程中随时检查动物的反应情况,如随时观察动物的肌张力、角膜反射、呼吸频率、夹痛反射等指标,避免动物出现死亡; (3)药液浓度 配制的药液浓度要适中不可过高,以免麻醉过急造成动物死亡;但也不能过低,以减少注入溶液的体积。
2、禁食禁水?
实验前,动物应禁食禁水。其目的是防止动物胃肠道胀气、呼吸道分泌物过多,常见的实验动物先天性无呛咳反应,倒是不用担心异物吸入。禁食禁水也更方便我们在麻醉前准备称量动物体重,此时麻醉用量更为准确。术前一天晚上开始禁食禁水,对于大动物而言,禁食至少要达到10-12小时。
3、如何确认动物已完全麻醉?
以小鼠为例,麻醉起效:小鼠仰卧时心跳及呼吸均匀、肌肉松弛、四肢无活动,胡须无触碰反应,踏板反射消失,即视为达到完全麻醉状态。若小鼠的前肢开始抖动即判定为开始复苏。手术过程中如果发现动物抽搐、排尿,说明麻醉过深,应立即进行急救。
4、若小鼠出现复苏迹象怎么办?
若实验还没有完成,小鼠接近苏醒,需及时将麻醉瓶(气麻)放在动物口、鼻处,给予辅助吸入麻醉或可临时适当补加麻醉剂,一般每次补加剂量不超过注射总量的20%到25%。
参考来源:
[1]. 实验病理学技术图鉴,潘琳主编,2012














