实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是一种以特异性致敏的CD4+T细胞介导为主的,以中枢神经系统内小血管周围出现单个核细胞浸润及髓鞘脱失为特征的自身免疫性疾病,其病理变化与多发性硬化(multiple sclerosis,MS)类似。
由于MS样本不易获取,因此EAE动物模型是研究MS病理过程、发病机制的重要途经,在临床神经免疫学的研究中具有重要意义。
从鸟类到哺乳类的多种动物如鸡、小鼠、大鼠、豚鼠、家兔、羊、犬、猴等均可成功诱发EAE,但不同种属或同一种属不同品系动物,其敏感性存在有很大差异,在选择动物时需要寻找EAE模型的敏感动物。对EAE敏感的动物有Lewis、DA大鼠,PL/J、SJL/J小鼠以及Hartley、Strain13豚鼠等,且鼠的EAE无论在临床表现、病理还是免疫、生化改变等方面都与人类脱髓鞘疾病较为相似,因此,目前大鼠及小鼠的应用最为广泛。
EAE诱导方案比较繁杂,各种方案发病机制不尽相同。
(1)主动诱导法
将抗原与佐剂的混合乳剂直接注射至动物体内,经过一定时间的潜伏期,诱导EAE的产生。
常用的致敏抗原有髓鞘碱性蛋白(MBP)以及蛋白脂(PLP)等。此外,髓寡树突细胞糖蛋白(MOG)、髓碱相关糖蛋白(MAG)等也是很强的抗原,髓鞘素(Myelin)、脊髓组织匀浆(SCH)、脑组织匀浆(BH)等也可作为致敏抗原。抗原的提取方法可参考文献。
通常不同品种动物对同一抗原的敏感性不同、不同抗原的抗原性也不同,并且不同来源的同一抗原的活性也有明显差异。在一定范围内抗原的量和EAE的发病率及发病程度有相关性,注射抗原佐剂乳化物的剂量越大,EAE的发病率越高。
提取的抗原需与佐剂混合制成抗原乳剂后才能致敏动物。抗原佐剂为非特异性免疫增强剂,它可改变抗原的物理性状,延长抗原在体内的储留时间,刺激抗原提呈细胞及淋巴细胞,从而增强和扩大免疫应答效果,它还能引起迟发性血脑屏障通透性增加和自身免疫反应。
最常用的佐剂为完全弗氏佐剂(CFA),它能够提高抗原的免疫反应强度并延长免疫反应时间,提高模型重复率,还可以刺激大量吞噬细胞摄取和呈递抗原以及CD4+T 细胞的活化与扩增。
百日咳杆菌疫苗(BPV)毒素能增加血管壁的通透性和血管表面粘附分子的表达,有利于致敏的T细胞透过血脑屏障,攻击神经髓鞘,造成对脑、脊髓组织的免疫损伤。(有研究表明于CFA中加入BPV可明显提高EAE的发病程度,可使EAE敏感性弱的Wistar大鼠变得敏感。)
目前诱导EAE鼠的常用途径有:髓鞘碱性蛋白(MBP)诱导诱导PL/J小鼠、髓鞘蛋白脂质蛋白(PLP)139-151多肽诱导PL/J小鼠、髓鞘少突胶质细胞糖白( MOG)多肽诱导C57BL/6小鼠等。
PL/J和SJL小鼠分别是MBP和PLP的敏感鼠,在国内难以获得,国内学者尝试用其他非敏感鼠类诱导,但所诱导的模型存在发病率不高或者发病症状轻微等缺点,并不够理想。
MBP诱导
髓鞘碱性蛋白(MBP)是一种由脊椎动物中枢神经系统(CNS)少突细胞和周围神经系统雪旺细胞分泌合成的强碱性膜蛋白。它是髓鞘中抗原性最强的蛋白质,占髓鞘总蛋白的40%,等电点在10以上,是强碱性蛋白质,研究表明MBP可激活体内Th+细胞,使之穿过血脑屏障,攻击自身神经髓鞘的MBP,从而导致中枢神经白质脱髓鞘,导致CNS炎性细胞浸润和髓鞘脱失,引起EAE或MS。近年来常用MBP68-86肽可在Lewis大鼠诱导急性EAE,此模型病程较短且无复发过程、发病时间均齐、发病率较高、病情也最重,经组织病理学检测发现该模型鼠的脑和脊髓组织均以急性炎症为主要病变,髓鞘脱失情况不明显。
PLP诱导
蛋白脂质蛋白(PLP)是髓鞘蛋白中的结构蛋白,是髓鞘形成的关键性因素,对PLP不同肽决定簇发生反应的CD4+T细胞能诱导急性、慢性复发型及慢性进展型EAE。
MOG诱导
MOG是一种表达在中枢少突胶质细胞和髓鞘膜表面的跨膜糖蛋白,是免疫球蛋白IgG1的一种亚型,有效的调节补体依赖性细胞毒性反应,是导致MS脱髓鞘的关键成分。在体内含量很少却具有高的免疫原性,且其易感鼠C57BL/6小鼠国内常见。一般采用MOG35-55肽段致敏C57BL/6小鼠,同时腹腔注射百日咳毒素(PTX,使血管通透性增加,T细胞更易通过血脑屏障作用于神经髓鞘)建立EAE模型。研究报道MOG是唯一既能引起脱髓鞘抗体反应又能引起T细胞反应的中枢神经系统髓鞘蛋白成分,因此用MOG作为免疫原诱导的EAE能更好地为MS/EAE发病机制的阐明提供研究材料。优点:易于诱导,发病率高,病情发展缓慢,发病高峰期后病情逐渐稳定不复发,抗原用量小,操作简便,稳定性高。缺点:病变伴有继发性脱髓鞘的大量轴突变性,原发性脱髓鞘较少,与MS病理情况存在差异。病理改变主要发生在脊髓,对大脑的影响较小。
(2)被动转移实验
分离EAE抗原特异反应性T细胞转输给同一品系健康动物致健康动物发病,这是研究EAE发病机制的最直接证据,它也是研究EAE的治疗预防措施的良好模型。优点:脑内炎症不受外周淋巴组织中特异性免疫激活传入的影响,且具有高度的可重复性。适用于:研究控制CNS免疫监视、T细胞介导的炎性组织损伤的机制、T细胞进入CNS的方式、T 细胞的再激活状态对神经系统的重要性和T细胞的功能对脑炎症的影响等。下面以小鼠为例,具体介绍髓鞘少突胶质细胞糖蛋白(MOG)诱导的实验性自身免疫性脑脊髓炎(EAE)模型的建立。
前期准备
完全弗氏佐剂的配制:20 ml弗氏不完全佐剂(IFA)中加入10 mg结核分枝杆菌。漩涡混合仪充分混匀至悬浊状态,置于4℃冰箱冷藏备用,使用前再次充分漩涡混匀至悬浊状态。百日咳毒素储存液配制:将整瓶百日咳毒素(50μg)中加入500μl PBS,充分混匀,百日咳毒素的终浓度为0.1μg/μl,储存于4℃冰箱。诱导EAE时每只小鼠(大约18g左右)的用量为0.2μg,即2μl。MOG 35-55工作液的配制:10 mg的MOG 35-55溶于冷的500μl PBS 中,吹吸混匀(禁止涡旋)。此时MOG 35-55多肽的浓度为20μg/μl,分装于0.2 ml的EP管中,储存于-80℃冰箱。乳化物的制备:MOG 35-55多肽工作液按照所需剂量与预冷PBS充分混合,然后加入等体积的CFA,涡旋震荡充分混合。将混合液缓慢加入两只用三通相连的注射器中,尽量排除气泡,注射器互相推拉吹吸,直至形成油包水混合物为止(大概需要40分钟左右才能完全乳化)。因为抗原多肽在常温中易于变性,所以整个乳化过程应该尽量置于冰上,保持低温。注:
1. 肽段的纯度必须>98%
2. 在制作乳液的过程中,损失量是很大的(一般损失1/3—1/2)。理论上一只小鼠需注射MOG肽200ug,十只鼠2mg,但加上损失量,免疫十只鼠需称取4mg,以防损失后不够用。乳液剩余,可放入4度冰箱,一星期之内使用没问题。
3.乳液制备不能使用塑料注射器。
模型制备
一般选择:C57BL/6小鼠,雌性,6-8周,18-25克;小鼠的品系一定要纯,饲养环境一定要是SPF。否则易导致发病率下降!① 麻醉小鼠,并对小鼠注射部位(背部脊柱两侧,即双侧下肢后背皮肤)进行75%酒精消毒;② 每侧皮下注射抗原佐剂乳化物100μl(共注射 200μl),随后腹腔注射0.2μg(即2μl)的百日咳毒素;④第七天再次在小鼠背部脊柱两侧各注射100μl抗原佐剂乳化物加强免疫⑤小鼠经MOG免疫后,常规饲养小鼠,观察动物的一般情况。模型诱导首天记为Day 0,每天统计小鼠体重,观察并记录疾病的临床神经功能分级,直至 MOG 免疫后 30 天。注:C57皮肤很薄,用最小号针头稍用力就可刺入皮下,用力过大会造成串通,导致乳液漏出。
EAE小鼠模型判定标准
(1)神经功能评分
通常根据Knono等提出的标准,分为5级。1级:动物尾部无力;2级:尾部无力加肢体无力;3级:肢体轻度麻痹;4级:肢体严重麻痹,被动翻身后不能复原;5级:濒死状态。
(2)病理检测结果
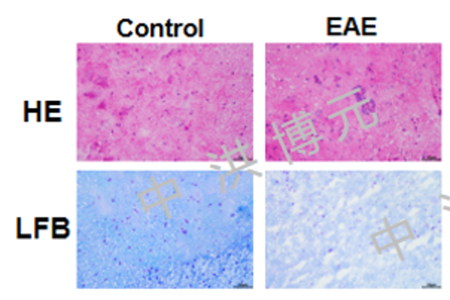
常规方法应用含4%多聚甲醛PBS液灌流动物心脏后,取脑和脊髓做冷冻切片,HE染色。在正常组小鼠脊髓中,发现少量炎性细胞;在EAE模型组小鼠脊髓中可见大量的炎性细胞聚集。在正常组小鼠脊髓中,髓鞘排列整齐,纹理清晰,髓鞘密度高,没有髓鞘脱失现象。与正常组小鼠相比,EAE模型组小鼠脊髓中均出现髓鞘结构松散,崩解,密度降低等髓鞘脱失情况。
(3)免疫荧光双染结果
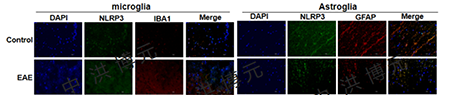
与对照组相比,EAE模型组小鼠脊髓中活化的小胶质细胞数量增多,而活化星形胶质细胞数量减少。
(4)细胞流式分析
与对照组相比,EAE模型小鼠中致炎细胞Th17数量显著增加,抑炎细胞Treg和Breg数量显著降低。
- EAE小鼠模型的构建及其免疫学机制的探讨,泰淑红等,2008
- 多发性硬化症动物模型的研究进展,张南炀等,2015
- 《人类疾病动物模型复制方法学》,周光兴等,2008