目前关于IBD确切发病机制尚不明确,研究指出,该疾病发展可能与遗传、免疫失调、环境和肠道菌群等因素有高度相关。临床上对IBD的治疗效果并不理想,寻找治疗IBD的新方法,提高IBD的治疗效果,一直是近年来的研究热点。
因此,建立IBD动物模型对于阐明IBD的病因和发病机制,从而达到有效防治的目的,具有重要的现实意义。目前已经开发出动物模型,主要可以分为以下几类:
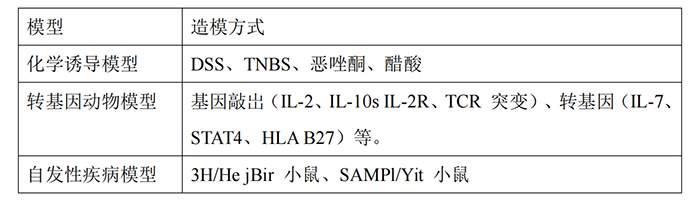
其中又以化学诱导的IBD模型建立最为完善,由于它们的可靠性、重复性好、成本低且容易开发。下面详细介绍:
01 化学诱导模型介绍
(一)醋酸诱导模型
造模机制:醋酸通过直接刺激肠黏膜,导致上皮坏死、血管损伤而使血管通透性增加;醋酸可激活激肽、促进纤维蛋白水解而干扰凝血,并通过激活环氧合酶和脂氧合酶途径而启动炎症的发生。
造模方法
Wistar大鼠,乙醚轻麻醉,将外径2mm的聚乙烯导管从肛门插入结肠8cm处,缓慢注入3%醋酸2m,经10秒完成注射,然后用5ml生理盐水冲洗2次,保持仰卧、头低脚高的位置30秒,以防止结肠内液体流出。 5天后可见动物腹泻、血便、体重下降、黏膜出血、上皮坏死、黏膜下水肿、中性粒细胞浸润等,炎症可逐渐延至固有层、黏膜下层甚至肌层。
模型特点:是一种暂时性的、非特异性的黏膜损害和急性炎症,自愈性较强。其炎症介质与人类急性肠炎的炎症介质相似。不足之处是不能确切反映人类UC的免疫学变化,不能表现人类的UC所具有的慢性、复发的特点。
模型评估和应用:该模型简单易行,成本低,周期短,重复性好,成功率高。适用于研究人类UC的急性期、炎症介质致炎机制及药物治疗机制和黏膜愈合机制研究,不适于免疫机制的研究。
模型诱导成功的关键是醋酸的浓度和作用时间,以产生弥散性炎症而不发生穿孔为宜。
(二)DSS诱导模型(本篇重点介绍)
葡聚糖硫酸钠(Dextran Sulfate Sodium Salt,DSS)诱导的肠炎模型,是目前肠炎造模研究领域的金标准。该模型目前应用比较广,其炎症表型与DSS注射的时间和剂量、小鼠的体重、品系和性别等研究得比较清楚。
DSS是葡聚糖的聚阴离子衍生物,由葡聚糖和氯磺酸的酯化反应形成,分子式为 (C6H7Na3O14S3)n,市售DSS分子量500-140000不等,常温下极易溶于水,常用的造模分子量为36000-50000Da。
DSS诱导结肠炎模型的机制仍未十分明确,目前的研究主要认为DSS增加肠道通透性、破坏肠黏膜屏障、上调某些细胞因子(肿瘤坏死因子、白介素、干扰素、IL-10和IL-12)、激活某些通路(NF-κB通路和TRPV1通路)或肠道菌群失调等有关。
造模方法
准备: 6-8周 C57BL/6,雌雄各半(适应性饲养一周,并可自由饮水和进食); 无菌水;DSS(分子量36000-50000Da) 实验步骤: (1)将DSS溶于蒸馏水中,配置成2%-5%(w:v,根据不同实验室的饲养条件以及不同的动物品系等可选择最佳饮用浓度)的DSS水溶液,然后用0.22μm的滤膜过滤。DSS溶液配制好完成后可在4℃避光保存。 (2)小鼠标记并称取基准体重。 (3)通过给予动物自由饮用不同浓度的DSS水溶液,根据用药时间及用药周期可制成急性和慢性两种结肠炎模型。 ① 急性肠炎 给待造模动物饮用DSS溶液(2%~5%)5-7d,该阶段不给予任何其他水源;对照组则饮用经过灭菌的蒸馏水。每天观察动物的一般情况,饮水量,体重,大便性状,以及是否有便血。计算动物每天的体重降低百分比,公式如下:[(体重—基准体重)/基准体重]×100。 喂食第7天时,处死动物,解剖取肠道组织,并做病理切片,HE染色。 急性结肠炎造模也是常用的结肠炎模型之一,因其制备简单、成功率高,且与人类UC病变相似,是研究UC发病机制和评估药物疗效较为理想的模型。急性造模一般采用较高浓度的DSS建立,给药时间较短。 急性期结肠炎模型表现:结肠充血、水肿、变短、变脆、重量长度比增加,出现不同程度的结肠溃疡,黏膜水肿、杯状细胞缺失、隐窝肿胀破坏,黏膜和黏膜下层出现不同程度的炎症细胞浸润,上皮细胞损伤。 ② 慢性肠炎 给待造模动物饮用DSS溶液(2%~5%)5-7d,第8天将DSS溶液更换为不含DSS的清水,清水摄取持续14天后,重复前面的步骤2-4次。每天观察动物的一般情况,饮水量,体重,大便性状,以及是否有便血。计算动物每天的体重降低百分比,公式如下:[(体重—基准体重)/基准体重]×100。 在最后一个循环周期的最后一天,处死动物,解剖取肠道组织,并做病理切片,HE染色。 慢性结肠炎模型则可采用低浓度DSS建立,但给药时间较长,如给予小鼠1%~3% DSS自由饮用数个星期即可。 慢性结肠炎模型表现:小鼠结肠明显缩短,上皮增生、黏膜纤维化和淋巴结肿大;小部分动物可见肉芽组织增生和肿瘤样改变。
模型优势
模型应用
DSS模型多用于UC发病机制研究和大多数药物治疗药效研究,但不适合T细胞介导的免疫反应的研究。
DSS诱发结肠炎模型的常见用途包括:研究先天免疫系统如何参与肠道炎症,以及寻找在损伤期间/之后维持或重建上皮完整性的重要环节。 DSS诱导的小鼠结肠炎模型也对环孢菌素A有响应,因此可以用来评估针对相同免疫机制的新药,例如新的免疫抑制剂。
(三)TNBS诱导模型
三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)本身不具有抗原性,但与宿主蛋白结合后会引起免疫反应,因此属于半抗原。常和乙醇、醋酸等合用。
TNBS处理小鼠可建立模拟临床克罗恩氏病(CD)的临床前模型,其产生的免疫反应是Th1介导的,特征在于CD4+T细胞、嗜中性粒细胞和巨噬细胞的浸润,形成横向进展的炎症,导致透壁结肠炎。
TNBS诱导的结肠炎模型非常适合研究CD的免疫学,也可以用于测试新免疫疗法的疗效,但不适用于对免疫机理的研究和对疗程较长药物的药效观察。
造模方法
动物:6-8周BALB/c小鼠。 试剂:TNBS、橄榄油、无水乙醇、丙酮、1mL注射器、软管(可用胆汁插管的软管)、涡旋仪 试剂配制:首先将TNBS溶于水,配制成5%TNBS(w:v)水溶液,然后配制橄榄油与丙酮比例为1:4(v:v)的均匀混合溶液,使用该混合液将5%的TNBS稀释为1%的TNBS溶液(或首先将TNBS溶于水,配制成5%TNBS(w:v)水溶液,然后使用无水乙醇将5%的TNBS稀释为1%的TNBS溶液)。 造模:小鼠背部去毛(1.5x1.5 cm),取配制好的1%的TNBS溶液150 μL均匀涂抹在去毛位置,七天后,动物称重并标记,小鼠麻醉后使用1ml注射器通过软管将100 μL的1%TNBS缓慢注射进入小鼠直肠内(软管插入直肠的长度大约4 cm),小鼠倒立保持约1 min,然后将动物放置回笼内,造模后持续观察动物状态,通过DAI评分判定动物成模情况。
(四)恶唑酮诱导
恶唑酮也属于半抗原,但会引起与TNBS诱导不同的炎症反应,它诱导的免疫反应是Th2介导的,会导致弥漫性结肠炎症。该模型用于研究皮肤中的迟发型超敏反应,也用于评估靶向Th2介导机制的药物。
造模方法
实验动物:6-8周BALB/c小鼠 试剂:恶唑酮、橄榄油、无水乙醇、丙酮、1mL注射器、软管(可用胆汁插管的软管)、涡旋仪 试剂配制: 配制橄榄油与丙酮比例为1:4(v:v)的均匀混合溶液 用水稀释无水乙醇得到50%乙醇 称取一定量的恶唑酮,使用橄榄油/丙酮混合液溶剂,配置成3%的噁唑酮给药溶液(或者用50%的无水乙醇配制得到1%的恶唑酮给药溶液)。 造模: 小鼠背部去毛(1.5×1.5 cm),取配制好的1%恶唑酮溶液(50%乙醇溶解)150 μL均匀涂抹在去毛位置,七天后,动物称重并标记,小鼠麻醉后使用1ml注射器通过软管将100 μL的恶唑酮给药溶液缓慢注射进入小鼠直肠内(软管插入直肠的长度大约4 cm),小鼠倒立保持约1 min,然后将动物放置回笼内,造模后持续观察动物状态,通过DAI评分判定动物成模情况。 02 模型评估指标
1)疾病活动指数(DAI)的评估
每天观察动物体重、大便性状和隐血情况,按照下表进行评分,将各项评分相加,得出每只动物的DAI,以评估疾病活动情况。
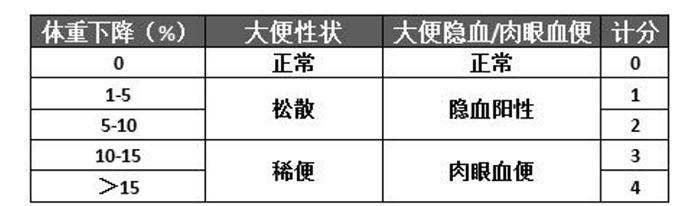
正常大便:成形大便;松散大便:不粘附与肛门的糊状、半成形大便;稀便:可粘附与肛门的稀水样便。(来源:小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价)
2)组织学损伤指数(HI)的评估
观察结肠内有无出血,溃疡等。取一小块组织常规石蜡包埋、切片、HE染色,观察组织学改变并按照下表进行评分,HI用黏膜损伤程度及范围积分的和来表示。
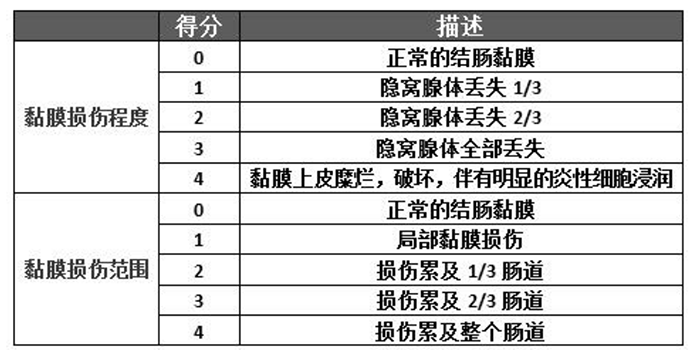
(来源:小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价)
3)病理切片(HE染色)观察
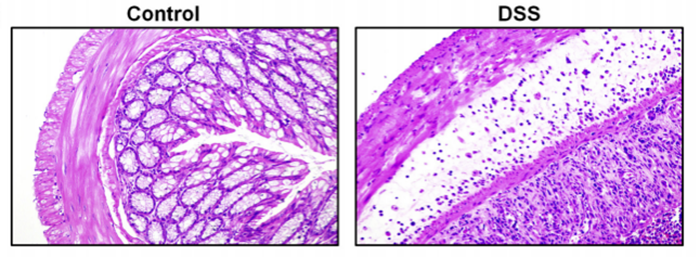
对照组:结肠黏膜完整,黏膜上皮完整,腺体排列规则,结构清楚,无炎症细胞浸润及溃疡。DSS实验组:结肠黏膜破坏,腺体排列不规则甚至消失,炎性细胞浸润,腺体脓肿,溃疡等。(DOI:10.1016/j.jnutbio.2020.108438)
4)其他,如过氧化物酶(MPO)的活性分析、促炎性细胞因子的测量分析
结语
不同的诱导剂对应不同的临床适应症,我们可以根据实验需要、技术能力选择相应的模型。在研究中,还应始终确保使用相同的方案,以确保实验可重复性,化学品批次、动物品系、性别、来源、化学供应商、剂量、频率和持续时间都可能影响到造模的重复性。














