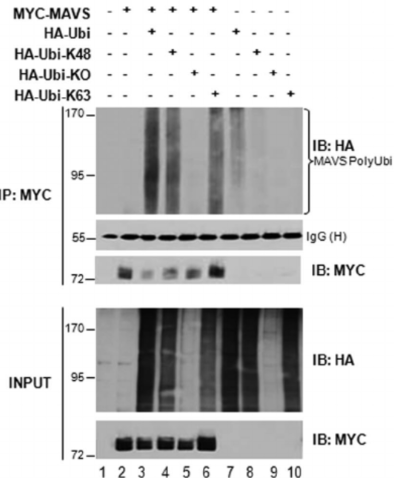
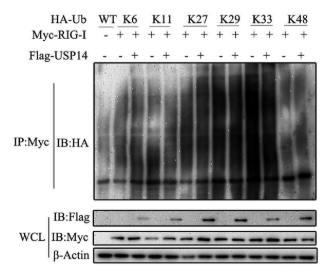
今天我们就盘点下泛素的相关质粒如何选择构建?
泛素于1975 年首次被发现,其在 ATP 依赖性蛋白水解中的重要作用于1978年被发现。无数研究证实了泛素介导的蛋白质降解如何在许多细胞事件中发挥重要作用,例如基因转录和细胞周期进程。将泛素添加到底物蛋白中称为蛋白的泛素化,由 26S 蛋白酶体介导降解,是常见的翻译后修饰,其生理意义等同于磷酸化、乙酰化和甲基化。
泛素本身是一种具有 76 个氨基酸残基 (8.6 kDa) 的小蛋白质,在所有真核生物中都高度保守 ,泛素中有七个赖氨酸 (K) 残基(K6、K11、K27、K29、K33、K48 和 K63)以及第一个氨基酸(M1),已被确定用于泛素化链:

76 个氨基酸的蛋白质泛素与其他蛋白质的结合可以改变底物的代谢稳定性或非蛋白水解功能。一旦附着在底物上(单泛素化),泛素本身就可以在其七个赖氨酸 (K) 残基或其 N 末端蛋氨酸 (Met) 上的任何一个上泛素化。单一的泛素聚合物可以包含混合的键和/或两个或更多个分支。此外,泛素可以与泛素样修饰剂(如SUMO)或小分子(如磷酸盐)结合。泛素通常以链的形式与靶蛋白相连。第一个泛素分子通过其 C 端羧酸酯基团共价结合到靶蛋白的特定赖氨酸、半胱氨酸、丝氨酸、苏氨酸或 N 端。然后,添加额外的泛素以形成一条链,泛素常在相同的赖氨酸连接,称为同型,若不同位点的赖氨酸连接,则称为异型。
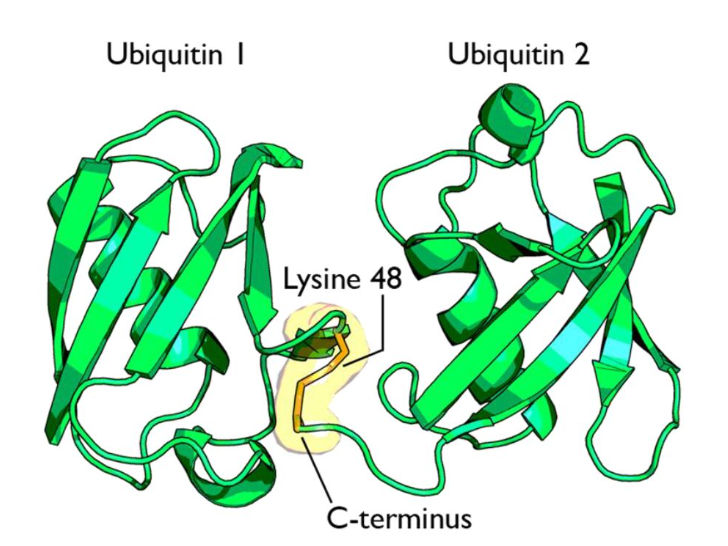
同型K48双分子泛素连接
泛素化分为三个过程:E1是泛素激活的过程,是一个相当简单的酶促反应,在ATP的介导下激活泛素分子;E2是泛素结合,活化的泛素从 E1 酶转移到泛素结合酶或 E2 酶;E3是泛素化的最后阶段,泛素标签最终转移到靶蛋白上。
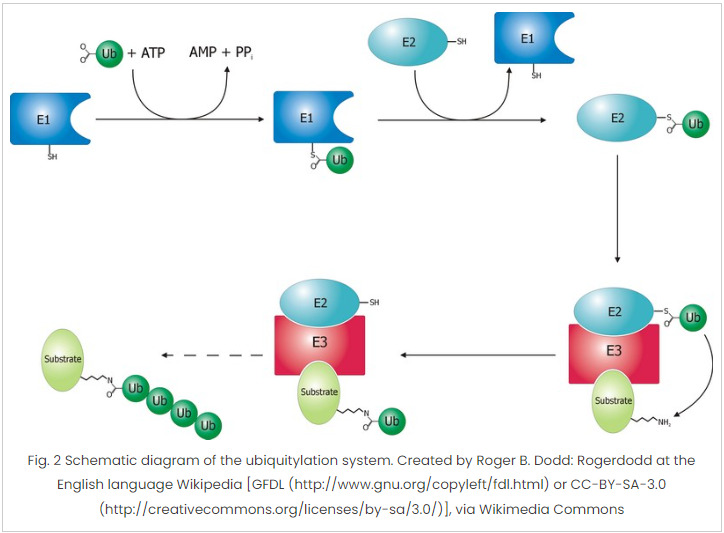
泛素化是一个极其复杂的过程,参与的分子包含2个E1 蛋白、40个E2 蛋白、>600个E3 蛋白,可见其复杂度,小编不做延展介绍,了解了泛素的基本原理以及过程,接下来重点盘点下各位点参与泛素过程的特点:
01
K48
K48-多聚泛素链是细胞中最丰富的连接,被认为是蛋白酶体介导的降解的主要信号,已被确立为蛋白酶体降解的典型信号,K48 多聚泛素链与 26S 蛋白酶体结合并刺激蛋白质降解,将酵母的K48突变会直接导致菌株死亡,而其他位点突变则不会,显示出K48在细胞生命活动中的重要地位。
02
K63
K63-多聚泛素连接在细胞中也非常丰富,可提供蛋白酶体介导的降解的替代功能,K63 连接的泛素化不会诱导蛋白酶体依赖性降解,而是作为蛋白质/蛋白质相互作用的分子平台,对于激酶信号传导激活、受体内吞作用、蛋白质运输和 DNA 损伤修复很重要,还可以将蛋白质靶向内体–溶酶体系统。如K63连接的 Akt 激酶泛素化,进而促进 Akt 膜聚集和随后的 Akt T308 磷酸化和活化。
03
K11
K11 连接的多聚泛素链是细胞中第三丰富的连接,最典型的作用是在细胞周期中起作用,在有丝分裂中,后期促进复合物/环体 (APC/C) E3 连接酶催化细胞周期蛋白(例如,细胞周期蛋白B1和securin)上的多泛素链形成,从而发出这些有丝分裂调节剂降解的信号,在其他细胞过程中观察到 K11-多泛素化,包括 ER 相关降解 (ERAD)、缺氧反应、线粒体自噬,甚至用于稳定蛋白质,例如 β-连环蛋白;K11还能与K48形成异型 K11/K48-多聚泛素链与蛋白酶体结合并提供降解信号,但它们不如同型 K48-多聚泛素链有效 。
04
其余位点
在细胞中检测到M1、K6、K27、K29 和 K33 泛素连接均处于低水平,作用不太明显,但有关其具体功能的数据才初见端倪 ,K6和K27 连接与 DNA 复制修复有关,而 K29 和 K33 被参与 Wnt 信号 (TRABID) 的 DUB 水解;M1 连接的泛素化在总连接中的百分比为 0.01-0.02%,与炎症、抗凋亡和免疫途径相关的 NF-κB 激活中发挥重要作用。由于丰度低,研究的人相对较少,更多的功能还待进一步发现。
05
关于突变解释
文献经常会写K48,K48R,它们有啥区别呢?解释如下,K48R就是将48位的赖氨酸突变为精氨酸,其余位点不变;K48是将48位保持赖氨酸不变,其余的K突变为精氨酸;考虑到泛素连接作用可能是多个点起作用,相对而言,仅保留目标位点,将其余位点突变可能是较优选择。
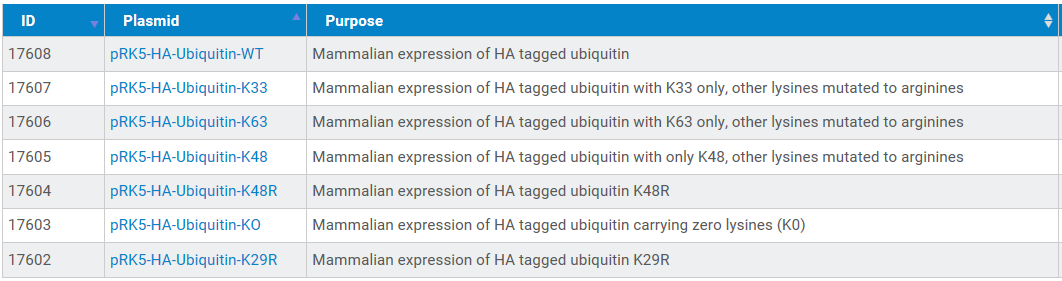
最 后
定量质谱研究表明,大约 80% 的泛素链包含K48 和K63 键,当前绝大部分文献均同时做这两种类型的互作验证,因此我们建议这两个位点突变型及野生型可纳入优先考虑项;其余位点,可根据目前报道出的功能选择性做。当然,本身泛素质粒各类型突变做的较多,吉凯拥有全部类型的现货质粒,实验成本也是比较低的,本着不遗漏的目的,老师们也可以全选,可能会发现其余位点新的泛素化分子机制!!!
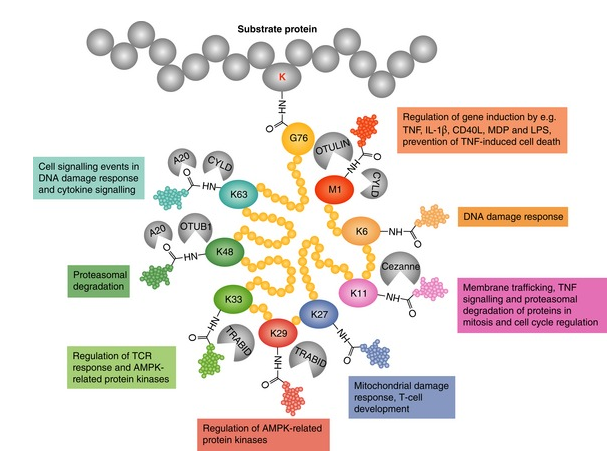
各位点参与的分子机制
【参考文献】
1. Protein standard absolute quantification (PSAQ) method for the measurement of cellular ubiquitin pools;
2. The Ubiquitin System: Functional Complexity And Semiosis Joined Together;
3. The evolving world of ubiquitin: transformed polyubiquitin chains;
4. The recognition of ubiquitinated proteins by the proteasome;
5. K63-linked ubiquitination in kinase activation and cancer;
6. Diversity of Polyubiquitin Chains.
来源:搬砖小陈,凯吉基因














