Western Blot虽是实验室最常用的蛋白分析技术,由于其操作流程长,影响因素多,想获得准确、一致的漂亮结果也并非易事。相信大家都遇到过信号若隐若现、背景糊成一片、条带极其诡异的情形。针对高频WB异常结果,我们分析了常见原因及优化建议,让你的条带显露真身。

信号弱或无信号
化学发光底物选择不当或失效
解决方案
✦ 更换灵敏度更高的WB底物再次检测。例如低fg级灵敏度的SuperSignal Femto超敏化学发光底物。
✦ 通过暗室实验排查WB底物的效价。混合发光底物的A/B液,在暗室中加入1µL未稀释的HRP二抗,如果很快看到蓝色亮光,说明底物没问题;如果没有看到蓝色亮光,可再更换一支新鲜二抗再次检测,如果这次看到有蓝色亮光,则说明刚才所用的二抗有问题,如果依然没有蓝色亮光,则说明底物效价可能变低或者失效了。
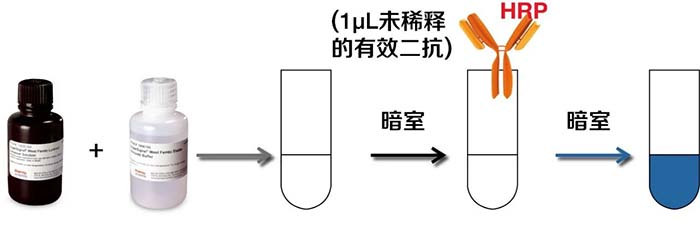
底物效价变低通常有两种原因:
✦ 保存不当。通常建议在4度或室温下保存底物(以厂商说明书为准),如果放在了-20度下,或冷藏室的通风口/内壁这种温度较低的位置,容易发生底物灵敏度降低的状况。
✦ 交叉污染。使用同一个移液管或枪头吸取底物A/B液,这样会造成交叉污染,随着时间延长,进一步造成底物的消耗。
抗体亲和力弱或浓度过低
解决方案
✦ 所用抗体与目的蛋白结合力低。说明书上的抗体浓度一般为推荐使用浓度,由于样本以及实验条件的不同,推荐浓度不一定是自己实验中合适的抗体浓度。在出现没有信号的问题时,可以通过斑点印迹实验(下文详述)来寻找合适的抗体浓度。需要留意的是,如果一抗或者二抗浓度过高,容易导致低信噪比(高背景或者杂带很多),也会因此浪费更多样品和精力。所以抗体浓度并不是越高越好;此外,还可尝试使用信号增强剂以提高印迹的信噪比;在经费允许的条件下,也可直接更换品质更好的抗体再次检测。
✦ 抗体效价降低或已失效。可通过斑点印记实验(下文详述)重新确定合适的抗体浓度,或者更换抗体。
转印不充分或转印过度
理想条件下,转膜后只会在膜上看到预染marker条带,在胶或滤纸上几乎没有条带的存在。
解决方案
如果在胶上看到有大量蛋白Marker残余,膜上marker条带较浅,则说明转膜不完全。那么可通过以下方式进行优化:
✦ 增加转膜的电压、电流或时间
✦ 降低凝胶厚度,如从1.5mm改为1.0mm
✦ 对于大分子量蛋白的转印,可以在转膜液中添加低浓度的 SDS(一般<0.1%),或适当降低转膜缓冲液中的甲醇浓度至10%或更低
如果怀疑信号弱是由于转膜过度,可通过以下优化方式再次尝试,帮助排查原因:
✦ 减小转膜的电压、电流或时间
✦ 选择孔径更小的膜(如0.2µm)
✦ 对于小分子量蛋白的转印,确保转膜液中不含SDS,适当提高甲醇浓度(20%)
封闭液不合适
解决方案
不同的体系需要不同的封闭液。不是所有检测系统(HRP/AP/生物素)都适合用脱脂牛奶或BSA进行封闭。对于相同的检测系统,同一种封闭液在不同蛋白上的封闭效果也是不一样的。所以一个检测体系的最优封闭液是需要测试与优化的。

图1. 不同封闭液对同一种蛋白的封闭效果不同,对不同的蛋白使用同一种封闭液进行封闭的效果也存在差异。

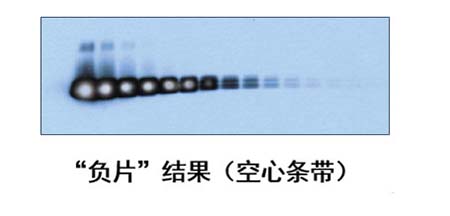

如果已验证底物没有问题,这些情况通常是由于二抗浓度过高引起的。二抗是加得越多信号越好吗?No!No!No!这可是常常被忽略的一个要点。通常,化学发光的信号强度与持续时间取决于系统中酶与底物的比例,而底物浓度是恒定的。在这种情况下,酶的浓度过高不仅不能增强信号,反而会导致底物迅速消耗,信号很快就没了。这样稍不留意,得到的就是没有信号的结果。如果选用的酶与底物比例合适,也许开始时信号强度不是很高,但信号持久度和稳定性会很好,可帮助获得重复性更好、更理想的结果。所以,二抗的浓度要适宜。
解决方案
既然合理的一抗/二抗浓度很重要,那么应如何优化抗体浓度呢?推荐进行斑点印迹。
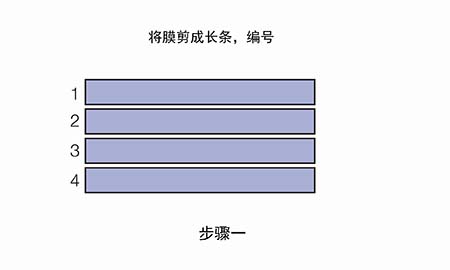
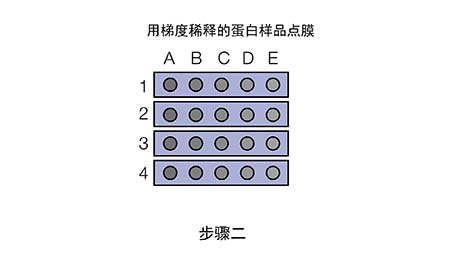
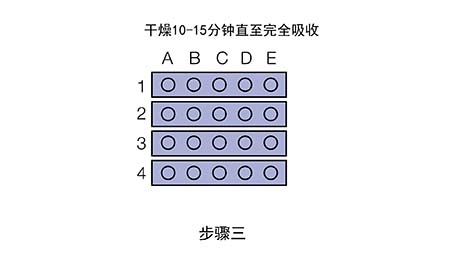
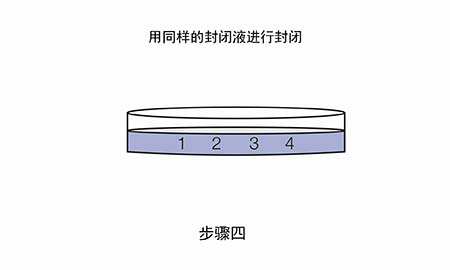
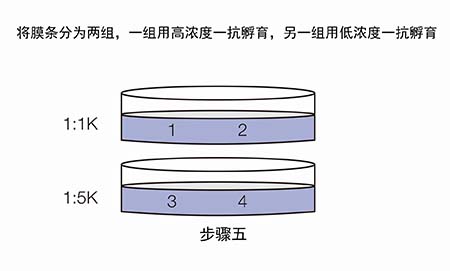
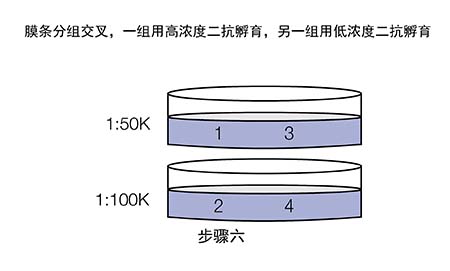
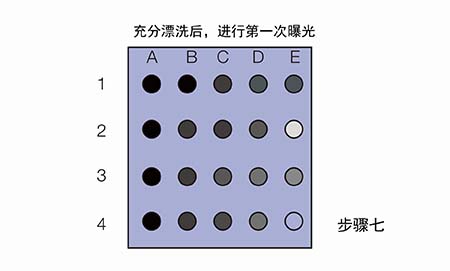
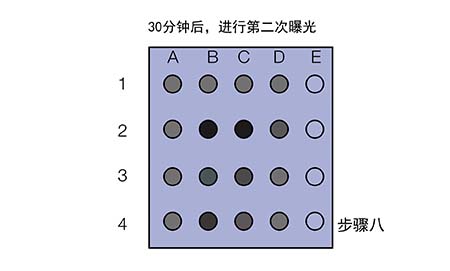
现在我们拿到了两张信号图,应该如何分析来选取合适的抗体浓度呢?
Ø 若两次曝光的信号都很弱,如E3和E4,说明膜条3和4所用的一抗浓度过低(1:5K稀释);
Ø 若第一次曝光信号很好,第二次曝光信号迅速衰减,如A1和B1,说明膜条1和2所用的一抗/二抗浓度过高;
Ø 若两次曝光的信号都比较好,结果稳定,如B2和C2,说明对于膜条2所用的一抗和二抗稀释比是合适的
此外,即使是同一张膜条(如膜条2),不同点的信号强度与持久度也有所区别,这说明抗原浓度也会影响信号,样品浓度过高时会结合更多的一抗,进而结合更多二抗,造成信号迅速衰减。所以上样量也不是多多益善的。

成片状高背景,条带信号强
一抗浓度过高或者特异性低
解决方案
通过点膜实验优化一抗的浓度(见上文详述);更换特异性更好的一抗。通常单克隆抗体的特异性会高于多克隆抗体。
蛋白样品的丰度过高
解决方案
适当减少蛋白样品的上样量。
封闭液不合适
解决方案
同上文详述。
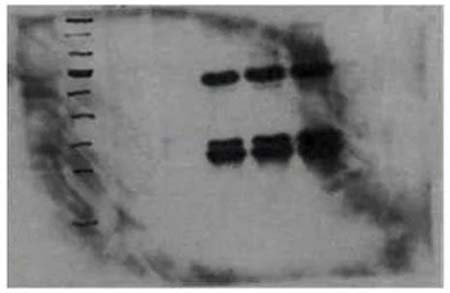
不规则高背景
漂洗不充分
解决方案 增加洗膜次数和洗膜时间,并确保漂洗缓冲液的体积完全覆盖印迹膜。此外,可在漂洗缓冲液中加入0.05% Tween-20。但如果Tween-20的浓度过高,可能导致膜上的蛋白剥离。所以切勿在StartingBlock T20封闭缓冲液和SuperBlock T20封闭缓冲液中再额外加入Tween-20。因为这两种封闭缓冲液中已含有Tween-20。 Tips 部分区域有空白 转印过程操作不当 解决方案 确保转印过程中凝胶与膜充分接触,推荐使用印迹滚筒来赶气泡;如使用PVDF膜,确保膜充分浸润和活化;保证除去胶与膜之间的残胶、碎胶;避免膜在操作过程中变干;操作时避免手与膜的直接接触,全程使用干净的设备(镊子和剪刀等)。
转自:赛默飞生命科学














