肿瘤免疫研究的历史非常悠久,最早由Paul Ehrlich于1909年就提出了机体免疫系统具有识别和杀灭肿瘤的功能的假说。直到50年之后,由Prehn和Main通过小鼠肉瘤排斥实验证明了肿瘤细胞存在特异移植抗原,诱导机体产生特异的免疫反应。之后在1975年,thomas和Burent又提出免疫监视学说,认为机体的免疫系统能识别并杀灭癌细胞。最近是在2002年,经过系统的梳理和总结,由Schreiber 等首次提出肿瘤免疫编辑理论,并将其分为免疫清除、免疫平衡、免疫逃逸三个阶段。该学说认为机体的免疫系统能够识别、监视并最终“清除”绝大多数的恶变细胞;但可能会有少数恶变细胞躲过清除而进入“平衡”期,此期间免疫系统和恶变细胞相互塑造但机体并不表现出临床症状,平衡期在极端情况下甚至可涵盖机体整个生命过程;但恶变肿瘤细胞的主动作用一旦打破这种平衡状态,肿瘤细胞将实现成功“逃逸”导致免疫系统丧失对肿瘤细胞生长的控制。
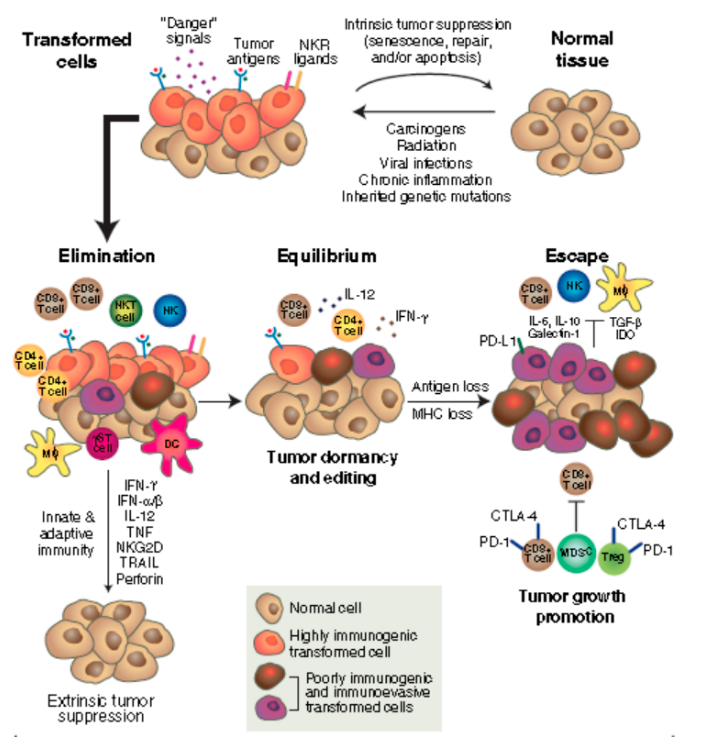
肿瘤免疫编辑学说
体细胞可偶然自发或由于各种致癌因子的作用发生基因突变,这些突变细胞一部分经 DNA 的自我修复可恢复正常,一部分死亡,少数突变细胞则会在其表面表达出一些新的抗原。这些新抗原作为“非己”物质,可以被机体的免疫系统识别和杀伤,机体可以通过天然和获得性免疫抵抗肿瘤。然而肿瘤在人体免疫功能作用下仍能发展、转移和复发,表明某些肿瘤具有逃避机体免疫监视的能力。至此,我们可以给肿瘤免疫逃逸下一个定义:肿瘤细胞可凭借诸如对自身表面抗原修饰、募集抑制性免疫细胞及分子及改变肿瘤组织周围微环境等途径来逃避机体免疫系统的监控、识别与攻击而继续分裂生长,这就是肿瘤的免疫逃逸。
肿瘤的免疫反应是肿瘤发生发展过程中的重要过程,脱离的机体免疫的监控后肿瘤的恶性生物学行为将会进一步加快,从而促进肿瘤的增殖、侵袭和转移,因此了解肿瘤的免疫逃逸机制对于肿瘤的治疗尤其是免疫治疗具有重要作用。肿瘤免疫逃逸的机制主要与肿瘤细胞自身的修饰变化和肿瘤免疫微环境的改变有关。通过修饰和变化机制,肿瘤细胞自身可增强逃避免疫监视及攻击的能力。自身修饰变化包括肿瘤的免疫选择、肿瘤细胞漏逸、肿瘤抗原的封闭覆盖及被识别为自体抗原、肿瘤细胞发动 Fas /Fas L 系统反击、肿瘤自噬体增加、肿瘤低氧代谢、受体表达异常以及上皮-间质转化的发生。后者在于肿瘤具有高度异质性结构,肿瘤细胞与包括免疫细胞、免疫因子在内的多种细胞和因子相互作用,形成复杂的肿瘤免疫微环境。其中免疫细胞、免疫因子的组成和功能也因肿瘤的存在而发生动态改变,免疫细胞常常因此获得免疫抑制性。导致非但无法清除肿瘤,反而使肿瘤细胞逃避机体的免疫监控和杀伤。
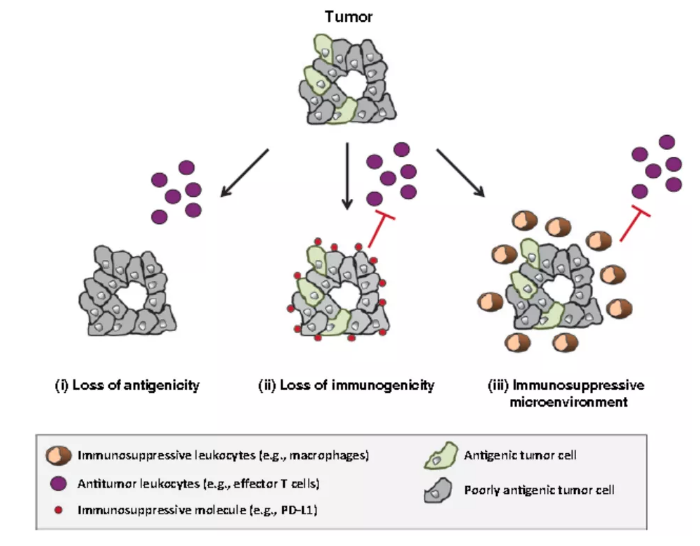
肿瘤免疫逃逸机制
下面我们就肿瘤细胞自身的修饰变化和肿瘤免疫微环境的免疫逃逸机制两大方向做稍微深入的探讨。
肿瘤抗原性的丢失或改变是最早被人们发现的肿瘤免疫逃逸机制,一般情况下,恶变细胞表达突变的抗原容易引发免疫系统对其清除,而肿瘤细胞能够通过不表达抗原来实现直接逃脱免疫系统的识别和破坏。此外,肿瘤细胞也可以通过不丢失抗原而实现逃逸。例如肿瘤特异性CD8+T细胞识别肿瘤抗原从而被激活,对肿瘤细胞进行特异性杀伤均依赖于TCR对MHC-I-肽复合物的特异性识别与结合,而为了有效逃逸免疫识别,肿瘤细胞可改变MHC分子和抗原肽之间的相互作用进而影响TCR对MHC分子抗原肽复合物的识别。 这里的免疫原性跟免疫治疗的PD-1息息相关。肿瘤细胞表面表达的PD-L1分子与浸润淋巴细胞表面PD-1的结合会抑制淋巴细胞的功能并诱导淋巴细胞凋亡,像PD-L1这类的免疫抑制分子可以使恶变细胞在即使被免疫系统识别出来的情况下能够实现免疫逃逸。PD-1的原理我们后边会深入开讲。除此之外,由于肿瘤细胞之间也存在免疫原性的差异,免疫原性较强的肿瘤细胞可以诱导有效的抗肿瘤免疫应答而易被清除,但是,免疫原性相对较弱的肿瘤细胞则能逃脱免疫系统的监视而选择性地增殖。经过机体对肿瘤的这一免疫选择的过程,肿瘤的免疫原性越来越弱。 肿瘤的发生说明肿瘤细胞已成功实现免疫逃逸,高通量组学技术研究对比肿瘤细胞和正常细胞发现,在肿瘤细胞内部以DNA甲基化、组蛋白修饰和micro RNA为代表的表观遗传信息发生了显著的变化,这其中包括对于肿瘤细胞逃避免疫监视非常重要的编码肿瘤抗原、细胞因子的基因。比如组蛋白H3K27me3的去甲基化酶UTX的突变参与T细胞急性淋巴细胞白血病的发生。 很多肿瘤细胞中伴随着NF-κB信号的持续性激活,这样可以使得肿瘤细胞避免细胞凋亡同时诱导肿瘤微环境的慢性炎症反应。此外,像JAK/STAT、PI3K/AKT、BRAF-MAPK等多种信号途径的变化也都参与协助或主导肿瘤的免疫逃逸。 肿瘤细胞分泌的细胞因子(如TGF-β、IL-10、IL-4及PGE2等)水平的增高会促进抗凋亡分子如Bcl-x L的表达,这样会打破细胞内促凋亡信号与抗凋亡信号的平衡,从而使得恶变细胞在免疫监视过程中抵抗自身细胞的凋亡。不仅如此,肿瘤还可以通过破坏细胞凋亡受体FAS和死亡受体(DR5)反应、瓦解Bcl2蛋白的平衡、凋亡抑制蛋白的失调以及减弱Caspase酶活性等方式来抑制细胞凋亡。 具有自我更新能力并能产生异质性肿瘤细胞的细胞被称为肿瘤干细胞(CSC),与其他一般意义上的干细胞类似,肿瘤干细胞同样也享有一定程度上的“免疫豁免”特权。在不同种类的肿瘤中,肿瘤干细胞抵抗免疫反应的机制可能是不一样的,如黑素瘤ABCB5+ CSC中MHC-I下调表达并且B7-H1上调表达,细胞免疫反应下降;神经胶质瘤CD133+ CSC中T细胞增殖减弱和凋亡增强、TGF-β上调、B7H1增加表达等方式削弱免疫系统对肿瘤干细胞的影响。 肿瘤实体不仅包括肿瘤细胞,还包括胞外基质、肿瘤浸润免疫细胞以及细胞因子等等,这些组成了肿瘤细胞的微环境。肿瘤微环境是免疫系统与肿瘤细胞进行博弈的场所,因此,免疫抑制的微环境在很大程度上决定了肿瘤细胞能否成功实现免疫逃逸。 肿瘤细胞分泌的mi R-124能够通过微泡传递给外围CD4+T细胞,肿瘤来源的mi R-124在CD4+T细胞中有效降低同源性磷酸酶张力蛋白(PTEN)的表达并促进Treg的扩增。Treg在肿瘤微环境中分泌免疫抑制细胞因子TGF-β和IL-10,使得CD4+、CD8+ T细胞、杀伤细胞介导的抗肿瘤效应被钝化。骨髓来源的MDSC具有显著抑制免疫细胞应答的能力,其高量表达诱导型一氧化氮合酶(i NOS )和精氨酸酶1,产生的NO诱导T细胞凋亡、抑制STAT5信号并形成过氧化亚硝酸盐,而精氨酸酶1大大减少肿瘤微环境中L-精氨酸的含量并破坏T细胞的增殖能力。MDSC还能通过限制T细胞的半胱氨酸的来源、分泌抑制性细胞因子如IL-10等以及过量产生活性氧的方式实现免疫抑制。另外,M2型巨噬细胞周围形成的IL-4以及其他促炎症因子的免疫抑制环境通过对抗M1型巨噬细胞的抗肿瘤功能、促进Treg功能和破坏效应T细胞等多种方式协助肿瘤细胞免疫逃逸。 本文上述提到的免疫逃逸机制有IL-4等细胞因子的参与,所以细胞因子无疑是确保肿瘤微环境免疫抑制特征的重要调节者。总体来讲,肿瘤微环境中的细胞因子的作用可以直接促进肿瘤细胞的生长或抑制肿瘤细胞的凋亡,也可以间接地通过影响血管生成和招募免疫细胞等方式维持有利于肿瘤生长的免疫抑制微环境。另有研究表明肿瘤微环境中其他的组分比如CD73分子能从ATP中生成腺苷抑制免疫系统。其他因子比如促进肿瘤增殖的生长因子、抑制肿瘤凋亡的生存因子、促肿瘤血管生成因子、促进组织重塑以及肿瘤侵袭转移的基质蛋白酶、促进上皮间质化的诱导因子等,加速炎症反应也能促进癌症的发展。
















