荧光定量PCR系统知识汇总
Q1:什么是荧光定量PCR?
答:指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个
PCR进程,使每一个循环变得“可见”,最后通过Ct值和标准曲线对样品中的DNA(or cDNA)的起始浓度进行定量的方法。
Q2:定量PCR原理?
答:与传统PCR一样,反应在温度模块里循环进行;理论上每经过一个循环目的基因的数量都会增加一倍;每个循环结束后,定量PCR仪器通过不同的滤光片记录荧光信号;在扩增过程中,荧光信号随着PCR产物的增加而增强。
Q3:定量PCR体系?
答:普通的PCR体系;模板,引物,dNTPs,buffer,Taq酶;加入各种类型的荧光染料。
在做Real time PCR时,对于SYBR Green I染料法和Taqman探针法都可以,但是二者有区别。SYBR Green I染料法是利用SYBR Green I结合双链DNA来检测PCR产物,可用于监测任意双链DNA序列的扩增,但是必须考虑非特异性扩增。因成本相对低,是目前较常用的(看来大家都穷,哈哈)。但是由于SYBRGreen I可以与所有的双链DNA结合,包括非特异性的双链DNA序列,因此可能会产生假阳性信号。
Taqman探针法使用荧光探针检测PCR扩增过程中产生的特异PCR产物:特异性荧光信号的产生,需要探针与目标序列进行特异性的杂交;探针可以标记不同的报告基团,因此可以在一个反应管中进行二条序列扩增完整的探针。5′端荧光基团吸收能量后将能量转移给临近的3′端荧光淬灭基团(发生荧光共振能量转移);退火,探针与模板结合,引物在聚合酶作用下进行延伸反应,遇到探针时发挥3′-5′外切酶活性将探针切碎到反应体系中;报告基团与淬灭基团距离变大,在激发光的作用下发荧光。实验结果重复性好,价格高,土豪课题组强烈建议用这个。
Q4:典型的PCR四阶段?
答:PCR存在典型的4个阶段,分别是基线期,指数增长期,线性增长期和平台期。
PS:基线就是背景值,也就是曲线在没有起飞之前的一段。一般在PCR程序软件上有一个地方可以输入baseline从第几到第几 cycle 作为基线。设置原则是使没有起跳之前最多的 cycle 的信号接近 0。
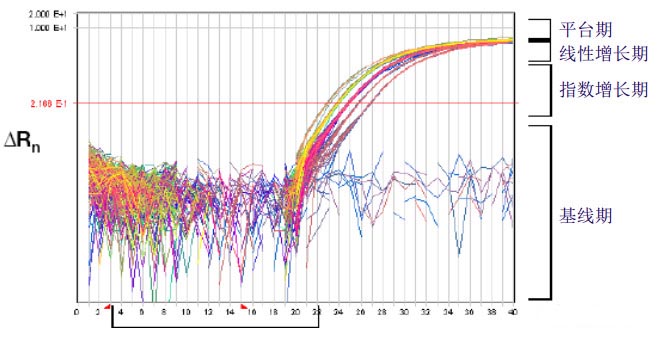
下图更清晰!
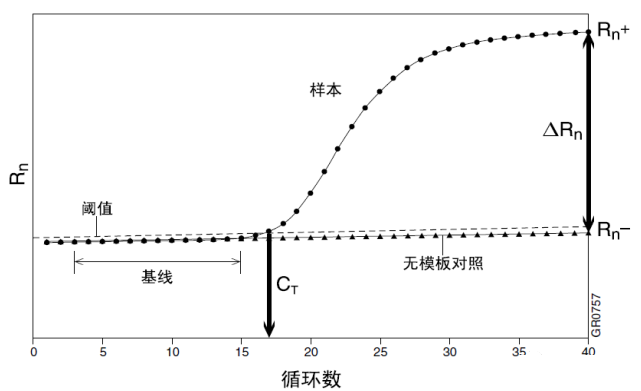
Q5:什么是阈值?
答:高于背景荧光强度的值被确定为阈值;控制在扩增曲线的指数增长阶段范围之内。阈值线与扩增曲线的交叉点确定CT值。
Q6:CT值的含义是什么?
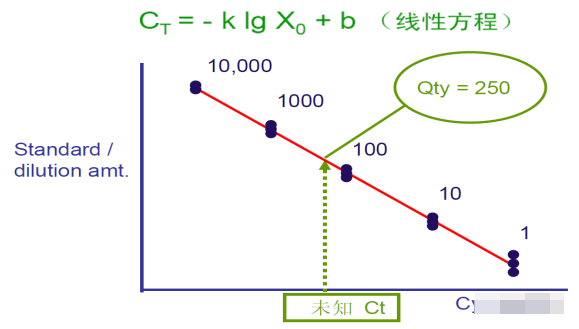
答:C代表Cycle,T代表阈值(threshold)。CT值的含义是:每个反应管内的荧光信号到达设定的阈值时所经历的循环数。其中蕴含的数学关系:Log浓度与Ct呈线性关系,根据样品扩增达到阈值的循环数就可计算出样品中所含的模板量。
Q7:溶解曲线 derivative view啥意思,有什么用?
答:反映结束后,温度逐步提升,双链产物在某一温度区域变性为单链,双链结合染料脱离出来,成为不发荧光的游离态。这一过程检测到的荧光值迅速降低,其监测值曲线即溶解曲线,不同产物的因其不同Tm值,会产生不同的溶解曲线峰。(关于各种曲线的解读,可参看往期内容)
Q8:PCR开始前的注意事项?
答:需要做ROI(Regions of Interest)校正;需要做背景校正,即检测PCR仪的环境荧光强度,尤其注意检测加热槽是否存在污染,若有则必须乙醇及去离子水反复清洗反应孔,直至确认无残留。
Q9:RNA提取方法?
答:RNA提取方法有多种。有机溶剂法,该法提取的样本纯度高,但是劳动强度大(小编心生感慨,为什么劳动强度大的方法总是最常用的方法)。过柱法:方便快捷,提取效率高,适用范围广,但是偏贵。磁珠法的产量很高,并且洗脱体积小,不用离心,适合高通量提取,也贵(哎!)。
道路千万条,快速第一条。一旦细胞死亡或者相关样本离开机体,很快就会被RNases酶降解,做芯片的朋友尤其得注意了。
Q10:目标样品用量 ?
答:DNA纯度:OD260/OD280=1.8,1.6-2.0之间;DNA用量:0.1ng-100ng 。
RNA纯度:OD260/OD280=2.0;cDNA用量:10-100ng。
Q11:标准品的注意事项?
答:标准品是用来生成标准曲线,并建立CT值与浓度之间的数学关系。浓度已知,Ct值在18-30之间,覆盖全部样品浓度区间制备至少5个点的10倍标准曲线(4 logs),PCR效率一致,且接近100% ,与未知样本实验条件平行,每个点至少要做3次重复。不要求标准品与目标基因使用相同的DNA。
1. R2≥0.99;
2. Eff%=90%-110%
3. Slope=-3.58~-3.10。
理想的斜率=-3.32(对应100%扩增效率);效率在90%-110%(斜率为-3.58到-3.10之间)都表示扩增较好 。
Q12:相对定量的含义和数据处理方法?
答:相对定量相对定量一般采用ΔΔCT法。

Q13:扩增效率达不到 100% 的原因有哪些?
答:比较Ct值的前提是每经过1个循环,产物的量会加倍在这种情况下,反应的扩增效率为100%。如果扩增效率下降,其中的数学关系不再成立,比较Ct值就没有意义。
导致扩增效率达不到 100% 的原因一般有以下这些:
1. 实验组分的浓度及质量。如果样品包含PCR抑制剂,反应会减慢,甚至不反应。这种情况常见于来自生物制品样本的核酸。cDNA作为起始模板时很少见;
2. 扩增产物太长实时定量PCR检测建议扩增产物序列长度为50-150碱基;
3. 没有选择合适的引物退火温度;
4. 设计的引物有错配 ;
5. 模板序列特殊(比如:GC含量高);
6. 二级结构的影响(引物、探针、扩增产物)。
Q14:无扩增曲线是怎么回事?
答:分分两大类来说。
1.通过电泳检测无条带,也无扩增曲线。a.引物设计问题;b.引物质量问题;c.扩增体系问题;d.退火温度问题。
2.电泳检测有条带,但无扩增曲线。a.程序设定问题或仪器出现故障;b.探针合成问题;c.探针淬 。
3.此外模板不足或者模板降解也需要注意。
Q15:扩增曲线不柔顺怎么回事?
答:请使用海飞丝(手动狗头)。
正经说。
1.探针与模板结合不稳定(曲线不平且荧光值低)。a.原始序列不准确或有SNP,导致探针不宜结合;b.将文献中的MGB探针序列直接合成taqman探针,退火温度过低。
2.仪器或试剂问题,可参考平行内参阳性对照扩增曲线。
3.罗氏lightcycler1.0或2.0要在体系中加BSA封闭。
4.调整探针或染料浓度。
Q16:出现斜线型曲线怎么回事?
答:探针降解(本底荧光值高),可以使用变性PAGE胶检测是否降解;体系中含有抑制成分。
Q17:Sybergreen法在35个循环之后阴性对照起飞了?
答:体系中组份的非特异扩增,引物二聚体的自我延伸。
Q18:溶解曲线出现多个峰?
答:1. 引物非特异扩增。2. 引物二聚体。3. 基因组DNA污染:在检测cDNA的时候,同时扩增出含有内含子的较长的基因组上的片段。其中第一条是最常见的原因,因此在设计引物时,至少有一条跨过两个外显子的接合处,使其无法与含有内含子的基因组DNA结合。
Q19:ROX染料是什么作用?
答:ROX用于荧光-校准物理误差。Master Mix中ROX浓度固定。ROX不参与PCR扩增,信号强度只与Master Mix用量有关。ROX的功能:耗材质量(如管盖厚度、透光性能)、仪器稳定性(如孔间、批间波动)等的误差,反应体系监控(蒸发)
校正方式:Rn=RReporter / RROX。即需要把这个差异用 ROX 来计算孔间差异有多大,然后差异系数去处理,实际的荧光信号。
Q20:PCR各组注意事项?
答:注意事项太多了,仅列举常见的。
• 实验室分区:样品处理区、PCR反应制备区、扩增区;
• 标准品的稀释最好使用独立的一套移液器;
• 标准品的稀释液中最好含有Carrier RNA;
• 移液器使用带滤芯的吸头;
• 先阴性对照样,后加样品,再加低浓度标准品,最后加阳性对照;
• PCR管上不可用记号笔标记;
• PCR管使用平盖或光膜,不要裸手触摸光盖或光膜表面;
• PCR管或8联排管要对称放置;
• 反应后的PCR管应当直接废弃,切不可在实验区域内开启;
• 采用UNG防污染系统,消除前次扩增产物的污染影响。














