科研人生美得很,回想当初第一次独立进行细胞实验的时候,发现自己还是不会细胞计数,哪怕已经跟着师兄师姐一起操作了N多回。害!这还不是科室经费不足惹得祸么!
经费要是足够多,可就能用上自动细胞计数仪了,但最准的还是原始版本的纯手动细胞计数(即用细胞计数板在显微镜下计数)。之前我偶然发现某大牌细胞计数仪使用一段时间后(大约三个月),它的系统就出现错乱,显示得出的细胞数量级还有参考性,但反应细胞死活的比例时,用细胞计数板加上台盼蓝手动计数的结果和用细胞计数仪标配的细胞计数板加上台盼蓝的计数结果相比较,得到了完全相反的数据,手动计数发现细胞成活率在95%以上,可仪器显示细胞死亡率在95%以上。所以,今儿个咱们还是需要好好了解一下纯手动细胞计数的详细步骤!
假如我们有个实验目的是准备给小鼠种皮下瘤,但这个实验对肿瘤细胞数量有着最低的要求,那么我们到底该咋办呢?
从培养箱中取出需要备用的肿瘤细胞,在显微镜下观察细胞是否为单层细胞,最好是处于对数生长期的细胞,然后用胰酶消化它,预期制备总的细胞浓度为6 x 106cell/3mL的肿瘤细胞悬液(用PBS制备细胞悬液)。
假设共有27只小鼠需要种肿瘤,每只小鼠2x 105个细胞,并注射100uL,因此可以准备30只小鼠的细胞量,即3000uL(3mL)体积的PBS里含有6x 106个细胞。于是我们期望细胞的数量能超过6x 106个细胞。
为了达成目的,我们将细胞处理的详细过程分为A和B两个部分:
A细胞计数的方法
[1] 准备计数板:用无水乙醇或 95%乙醇清洁计数板和盖玻片,待干燥后,把盖玻片覆在计数板上面,使之微微移向一侧,露出计数板台面少许;
[2] 用移液枪在计数板上盖玻片的一侧加微量细胞悬液,加样时不要溢出盖玻片也不能溢入两侧的玻璃槽内,如果产生上述情况需对计数板冲洗和拭干后重新加样,加样量也不要过少或带气泡;
[3] 在显微镜下,用 10×物镜观察,可见细胞均匀分散计数板各处。计算四角大方格内的细胞数,压中线者只计算左线和上线者,右线和下线不计算在内(即仅计算压两个边的细胞),成团细胞按单个细胞计算。按照下面公式计算细胞密度:
(细胞悬液的细胞数)/ml=(四个大格子细胞数/4) ×稀释倍数×104
大家是不是仍旧感到迷惑,没关系,我们举个例子来看,例如:
1 一瓶T75cm2 flask的肿瘤细胞为单层,状态良好,在生物安全柜中打开细胞瓶,弃去老旧培养液,加入PBS润洗两遍,弃掉PBS;
2 加入大约2mL 0.25% Trpsin-EDTA,室温或37°C消化1-2min,直到从底部能发现细胞与细胞之间出现透明的缝隙,用移液管去掉多余0.25%trpsin-EDTA,加入约6mL完全培养基将细胞轻轻吹打重悬,并将其转移到一支已经标记好(BSR)的心的15mL离心管中,并找到配平的离心管,1000rpm, RT(Room Temperature),离心5min;
3 弃掉上清,用大约6mL完全培养基重悬细胞后配平,1000rpm, RT(Room Temperature),离心5min(这里的离心是为了清洗细胞);
4 用1000uL移液器吸取上清并弃掉,用1mLPBS重悬肿瘤细胞,并将细胞轻轻吹打为单个细胞;
5 准备好已经用75%乙醇处理干净细胞计数板,晾干后,盖上盖玻片,用10uL移液器吸取10uL混匀的单细胞悬液至细胞计数板中,并在显微镜下10X开始观察,使用任何一种血球计数板时应当注意向计数栅格内加入细胞悬液的方法,正确的做法是从计数板上盖玻片的一侧加入细胞悬液,直至细胞悬液均匀散布于盖玻片下即可开始用手动计数器计数;
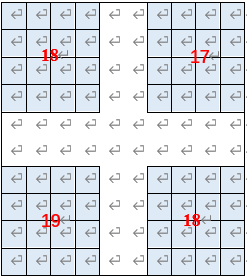
参考图1按照下面公式计算细胞密度:
(细胞悬液的细胞数)/ml=(四个大格子细胞数/4) ×稀释倍数×104
已知重悬细胞总体积1mL,取液10uL计数,细胞计数分别得到18/17/19/18,稀释倍数为100倍,因此代入公式后得到:
(细胞悬液的细胞数)/ml
={[(18+17+19+18)/4]×100×104}
=[(72)/4] ×100×104
=18×106cells/mL
=1.8×107cells/mL
因此1mLPBS重悬的细胞总数是1.8×107 cells/mL。
显然,这已经满足我们的细胞数量。
【注意事项】
[1] 消化单层细胞时,务求细胞分散良好,制成单细胞悬液。否则会影响细胞计数结果。
[2] 取样计数前,应充分混匀细胞悬液。在连续取样计数时,尤其要注意这一点。否则,前后计数结果会有很大的误差。
[3] 镜下计数时,遇见 2 个以上细胞组成的细胞团,应按单个细胞计算。如细胞团 10%以上,说明消化不充分;或细胞数少于 2 个/mm2或多于 50 个/mm2时,说明稀释不当,需重新制备细胞悬液、计数。
接下来,我们需要做的事情就是获得我们最终需要的3000uL(3mL)体积的PBS里含有6x 106个细胞。
B细胞浓度调整
同时假设现在细胞总数是刚刚得到的数据即1.8x107个细胞,那么我们可以根据下面这公式来得到我们的目标细胞数。
(预期目标需要的细胞数量/实际细胞总数量)x 1000uL=应从总细胞数量中取得细胞量
*(预期目标需要的细胞数量/实际细胞总数量):得到的是理想中目标细胞数占实际总细胞数量的比例。得到相关比例后乘以重悬细胞总体积1mL后可以知道应从总细胞中取得多少细胞量体积。
因此(6x106/18x106)x 1mL=0.33mL=330uL
故如果我们最后稀释的细胞可以是以下所示:
6x106个细胞的总体积为2mL670uL细胞生长液+330uL细胞重悬液。
最后只需要准备好这只调整好细胞浓度的肿瘤细胞溶液,就可以开心的去动物房啦!
也许有的小伙伴会问,为啥一会儿有台盼蓝,一会儿又没有呢?其实不管用不用台盼蓝,计算方法是一致的,因为台盼蓝染色后,活细胞是有很强的折光性,我们计数的细胞只算折光性强且完整的细胞,细胞膜明显破损没有完整形状且没有被染成蓝色的细胞是不纳入计算的。不用台盼蓝的话,我们也只纳入折光性强且细胞膜完整的细胞。
是否用台盼蓝进行细胞计数看需求而定哟!但是为确保实验万事大吉,个人比较建议还是加入台盼蓝比较好哦!














