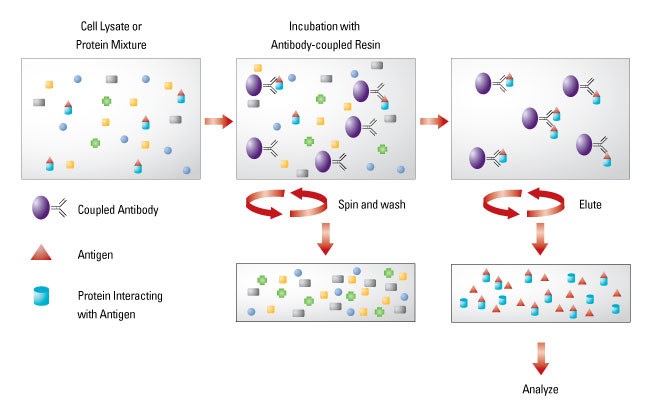
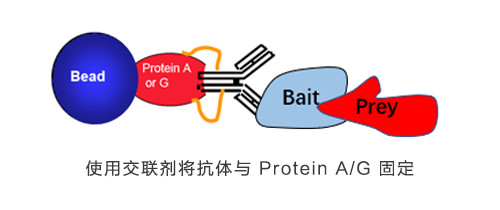
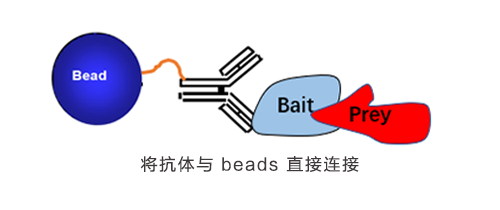
要守护爱情,先了解如何相处,一切从 CoIP 的原理谈起:免疫共沉淀是一种以抗体和抗原识别专一性为基础,用于研究蛋白质相互作用的经典方法。从原理示意图可见,免疫共沉淀利用抗原 (红三角) 与蛋白 (蓝圆柱) 的特异性结合,再通过连接着树脂的抗体 (紫圆球) 去识别抗原,从细胞裂解液或者蛋白混合物中捕获与抗原相作的蛋白。之后通过进一步洗脱,获取抗原-蛋白复合物,再对蛋白进行检测(Western Blot 或者 Mass spectra),即可获得蛋白间相互作用的信息。
了解了原理,再来看看操作,简单来说,可以总结为以下四个部分:首先进行样品制备,以提取出想要研究的蛋白,由于不同类型的细胞裂解条件有所差异,这里不展开介绍。- 细胞裂解要采用温和的裂解条件,避免破坏细胞内存在的蛋白间相互作用,裂解、洗涤时需使用非变性裂解液,如 NP-40 和 Triton X-100。
- 此外,由于不同细胞裂解条件不一样,建议通过预实验来确定最佳条件。
在共沉淀之前,先将固相基质与抗体共同孵育,从而使两者结合,常用的固相基质有琼脂糖 Agarose 和磁珠 Magnetic beads。琼脂糖 Agarose 具有简单易用,直径大,结合力强,多孔易吸附的特点;磁珠具有直径小,背景低,抗体消耗少的特点,但操作时需借助磁力架。- 抗体的选择十分重要,选经过 IP 验证的抗体,可以减少假阳性概率。
- 同时,要注意抗体/缓冲液的比例,抗体稀释过度不利于后续抗原抗体结合;而抗体过多就不能完全沉降在固相基质上,残存于上清。
- 操作时,为了避免损伤 beads,使用大口径或截短枪头进行加样。
根据不同的抗体结合方式,这里的免疫共沉淀步骤会稍有不同,但是本质是一样的,都是为了形成抗原-蛋白复合物。
- 如果直接使用 Protein A/G 结合的 beads,先进行细胞裂解液/蛋白混合物与抗体的孵育,再加入 beads 将蛋白-抗体复合物拉下来。
- 如果使用了交联剂将抗体与 Protein A/G 固定,或者直接将抗体固定在 beads,则将固定抗体的 beads 与细胞裂解液或则蛋白混合物一起孵育。
- 增加在洗脱之前的洗涤次数或在免疫共沉淀缓冲液中加入 Triton X-100 ,可以降低非特异性结合,以防止蛋白在阴性对照树脂实验样品中被检测到。
最后一步则是使用洗脱缓冲液将互作蛋白复合物洗脱,并通过 Western Blot 或者 Mass spectra 检测鉴定蛋白。当蛋白或抗体对低 pH 的缓冲液敏感,可使用中性 pH 值的洗脱缓冲液。
- 如后续需进行酶活或功能性分析,则需使用兼容下游检测的 Elution buffer 进行洗脱。
- 对于交联剂结合的 beads,为了保持抗体偶联树脂的活性,应立即再生和存储树脂,保证抗体可以重复利用。
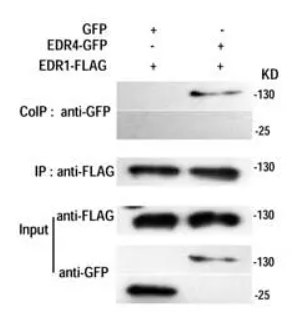
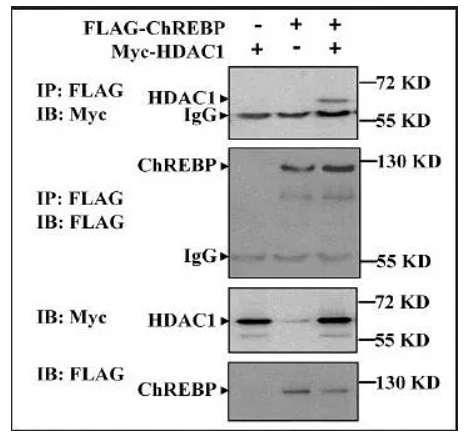
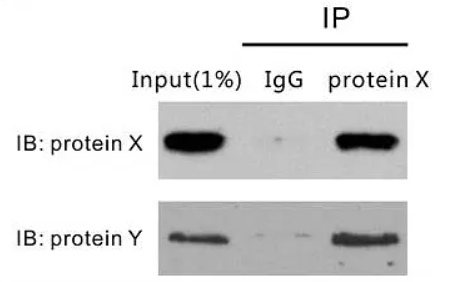
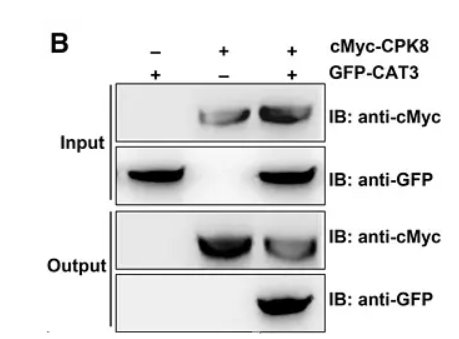
首先需要说明的是,熟悉了解免疫共沉淀实验的原理及实验的操作流程是进行Co-IP结果图分析的前提。在清楚知道Co-IP操作流程的前提下,弄清楚图中各个部分所代表的实验步骤,结合图中展示的结果进行分析,便可以看懂Co-IP的实验结果图。该图为验证蛋白EDR1与蛋白EDR4之间是否存在相互作用的结果图。由图中可以得到,蛋白EDR4带有GDP标签,蛋白EDR1带有FLAG标签,该实验为利用蛋白标签来沉淀和检测蛋白;该co-ip实验实验被分为两组,第一组存在GFP标签及EDR1-FLAG蛋白,第二组存在EDR4-GFP蛋白及EDR1-FLAG蛋白;图中共有三组胶图,分别是Inut组,IP组,以及CO-IP组。基本情况得到之后,开始进行分析:观察图片的顺序为Co-IP实验操作顺序相同。首先观察Input组,即阳性独照组。第一块胶图为利用anti-FLAG沉淀FLAG标签,发现两个条带都在130kd处有蛋白,说明两组实验都存在EDR1-FLAG蛋白且其大小为130kd,第二块胶图为利用anti-GFP标签沉淀GFP标签,发现第一条带在25kd存在蛋白而第二条带在130kd存在蛋白,说明第一组实验存在GFP标签,且大小为25kd,第二组实验存在EDR4-GFP蛋白且大小为130kd。随后观察IP组,该组图表示的是利用anti-FLAG对EDR1-FLAG蛋白进行沉淀,图上显示两组实验在130kd都存在蛋白,说明两组实验的EDR1-FLAG被沉淀下来。最后观察CO-IP实验组,该组图表示在IP组的基础上进一步利用anti-GFP检测GFP标签,图上显示第一组实验没有条带,而第二组实验在130kd处有蛋白。说明IP组没有把GFP标签共沉淀下来,但是把EDR4-GFP蛋白共沉淀下来了。说明EDR1-FLAG蛋白不能与GFP标签相互作用,但是可以与EDR4-GFP蛋白相互作用,由此可得到结论:EDR1蛋白可以与EDR4蛋白存在相互作用。该图为验证蛋白ChREBP与蛋白HDAC1之间是否存在互作的结果图。蛋白ChREBP带有FLAG标签,蛋白HDAC1带有Myc标签。该实验是利用标签抗体去沉淀及检测带有标签的蛋白。该实验共有三组,第一组为加Myc-HDAC1不加FLAG-ChREBP,第二组为加FLAG-ChREBP不加Myc-HDAC1,第三组为两个都加。实验共有四张胶图,分别为IB:Myc、IB:FLAG(这两张胶图为阳性对照),IP:FLAG IB:FLAG(IP组),IP:FLAG IB:Myc(Co-IP组),基本情况得到之后,开始进行分析:最下面两个胶图为利用IB验证Myc-HDAC1及FLAG-ChREBP存在的阳性对照。第二张胶图表示的实验操作是利用anti-FLAG沉淀FLAG-ChREBP蛋白,图上显示经IB验证第二、第三组FLAG-ChREBP蛋白被成功沉淀下来,而第一组没有结果(第一组不存在FLAG-ChREBP蛋白)。第一张胶图表示在anti-FLAG沉淀FLAG-ChREBP蛋白的基础进行IB检测验证Myc-HDAC1蛋白是否存在。图上显示第一、第二组实验没有检测到(第一组不存在FLAG-ChREBP蛋白,第二组不存在Myc-HDAC1蛋白),但是第三组实验检测到了Myc-HDAC1蛋白。由此可以得到结论:两个蛋白都存在的时候,当FLAG-ChREBP蛋白被沉淀,Myc-HDAC1蛋白也会被共沉淀下来,ChREBP蛋白与HDAC1蛋白之间存在相互作用。该图为验证蛋白X与蛋白Y是是否存在相互作用的结果图。由图可以发现,该实验被分为两组:input组及IP组,有两块胶图,第一块是IB验证蛋白X的存在,第二块是IB验证蛋白Y的存在。由对照组的条带可以得到结论:蛋白X与蛋白Y都是存在的。IP组的第一个条带表示利用IgG进行沉淀实验,结果蛋白X与蛋白Y没有被沉淀下来,说明蛋白X、蛋白Y不能与IgG结合(阴性对照,用于排除蛋白与抗体非特异性结合的可能性);IP组的第二条带表示利用蛋白X进行沉淀实验,结果蛋白X被沉淀下来,蛋白Y也被沉淀下来,由此得到结论:蛋白X-蛋白Y之间存在相互作用。该图为验证CAT3蛋白与CPK8蛋白之间存在相互作用的结果图。由图可以得到,两个蛋白分别加了标签,利用标签进行蛋白的沉淀及检测。实验共分三组,第一组为存在GFP-CAT3,不存在cMyc-CPK8;第二组为存在cMyc-CPK8不存在GFP-CAT3,第三组为两个都存在。实验共有两组胶图,一组为阳性对照组(Input组),另外一组为实验组(Output组)。由Input组可以得到结论:三组实验中的组分都是正确的。分析Output组发现:anti-cMyc在第二、第三条泳带都有,而anti-GFP只有第三条带有蛋白,由此推测实验组的实验操作为利用anti-cMyc进行沉淀实验,在利用IB检测GFP-CAT3的存在。从实验组第三条带可以发现当cMyc-CPK8蛋白被沉淀下来时GFP-CAT3蛋白也会被共沉淀下来,由此得到结论:cMyc-CPK8蛋白与GFP-CAT3蛋白存在相互作用。为了确保最终得到的结果是天然状态下的相互作用,而不是由于某些方面造成的人工相互作用(也就是“假阳性”),在Co-IP 的实验设计过程中,需要设置正确的对照。假设Co-IP 实验的实验组为“磁珠+抗X 抗体+靶蛋白X+目的蛋白Y”,则可能出现的“假阳性”及对应需要设置上述为了避免出现“假阳性”的对照称为阴性对照,除此之外Co-IP 实验还会设置一个阳性对照组(Input 组),Input 组为直接利用抗体X(抗体Y)对细胞裂解液进行WB 检测,验证细胞裂解液中存在蛋白X(抗体Y)。在某些Co-IP 实验中,实验人员会把IP 后的上清分别进行蛋白X 和蛋白Y 的WB 检测,该对照组称为output 组。利用内源性Co-IP 实验为验证两个蛋白是否存在已知作用,如果最终的结果为阳性,则可以证明两个蛋白之间存在相互作用;但如果结果为阴性,无法证明两个蛋白之间不存在相互作用,也有可能是蛋白在细胞内表达量低等原因导致。因此在进行内源性Co-IP 验证两个蛋白是否存在相互作用时,建议先做过表达Co-IP 作为对照。在免疫共沉淀实验中要保证实验结果的真实性,应注意以下几点:1.确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体具有特异性强、可大量生产、易标准化等优点,使用单克隆抗体有助于避免污染的发生;2.要确保抗体的特异性,如果抗体不能和细胞溶解物中的抗原结合,则不会引起共沉淀反应;3.确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的。
随着对蛋白质研究的不断深入,人们将免疫沉淀方法与其他方法结合起来,在其基础上衍生出许多较为复杂的技术,从而使得分析方法更为多样化,它的应用范围也相当的广泛。免疫共沉淀是用来研究蛋白质与蛋白质相互作用的一种技术,可以应用于蛋白复合物的研究。它可验证蛋白复合物的存在,进而发现新的蛋白复合物;免疫共沉淀技术与免疫印迹法或质谱等方法结合,用于确定诱饵蛋白-目的蛋白在天然状态下的结合情况,确定特定蛋白质的新作用搭档。免疫共沉淀实验也可以应用于低丰度蛋白的富集和浓缩。同时免疫共沉淀技术是一个相对比较经典的探讨蛋白质间相互作用的技术,在现代医学研究中应用范围广泛且可信度较高。蛋白质之间相互作用渗透于机体每一个细胞的生命活动过程中,生物学中会出现很多现象如复制、转录、翻译、剪切、分泌、细胞周期调控、信号传导和中间代谢等都受到蛋白质间相互作用的调控。有些蛋白质由多个亚单位组成,蛋白质之间的相互作用就显得尤为普遍。又有些蛋白质结合得十分紧密;而有些蛋白质却只有短暂的相互作用。可是不论出现哪些种情况,它们都控制着大量的细胞生命活动的事件,比如细胞的增殖、分化和死亡。且通过蛋白质之间的相互作用,能改变细胞内蛋白质的动力学特征,比如底物结合特性、催化活性,也可以产生新的结合位点,对改变蛋白质对底物的特异性有作用,还可以使其他蛋白质失活,其他基因表达得到调控。因此,只有让蛋白质之间相互作用得以顺利进行,细胞的正常生命活动过程才会得到保障。因为蛋白质之间相互作用具有如此重大的意义,所以它的检测方法的研究也备受关注与重视。自此以后蛋白相互关系的研究会愈演愈烈,未来不仅仅可以通过免疫共沉淀技术来证实,还将会有越来越多的先进技术值得去应用和发展。
1. 细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,多采用非离子变性剂(NP40 或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的。
2. 使用明确的抗体,可以将几种抗体共同使用。
3. 使用对照抗体:
单克隆抗体:正常小鼠的IgG或另一类单抗
兔多克隆抗体:正常兔IgG
4. 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生。
5. 要确保抗体的特异性,即在不表达抗原的细胞溶解物中添加抗体后不会引起共沉淀。
6. 确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的,这需要进行蛋白质的定位来确定。1. 用预冷的PBS洗涤细胞两次,最后一次吸干PBS。2. 加入预冷的RIPA Buffer(1 ml/107个细胞、10 cm 培养皿或150 cm2 培养瓶,0.5 ml/5×106个细胞、6 cm 培养皿、75 cm2 培养瓶)。3. 用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5 ml EP管中,4℃,缓慢晃动15 min(EP管插冰上,置水平摇床上)。4. 4℃,14000 g 离心15 min,立即将上清转移到一个新的离心管中。5. 准备Protein A agarose,用PBS 洗两遍珠子,然后用PBS配制成50%浓度,建议减掉枪尖部分,避免在涉及琼脂糖珠的操作中破坏琼脂糖珠。6. 每1 ml 总蛋白中加入100 μl Protein A琼脂糖珠(50%),4℃摇晃10 min(EP管插冰上,置水平摇床上),以去除非特异性杂蛋白,降低背景。7. 4℃,14000g离心15min,将上清转移到一个新的离心管中,去除Protein A珠子。8. (Bradford 法)做蛋白标准曲线,测定蛋白浓度,测前将总蛋白至少稀释1:10倍以上,以减少细胞裂解液中去垢剂的影响(定量,分装后,可以在-20℃保存一个月)。9. 用PBS将总蛋白稀释到约1 μg/μl,以降低裂解液中去垢剂的浓度,如果兴趣蛋白在细胞中含量较低,则总蛋白浓度应该稍高(如10 μg/μl)。10. 加入一定体积的兔抗到500 μl 总蛋白中,抗体的稀释比例因兴趣蛋白在不同细胞系中的多少而异。11. 4℃缓慢摇动抗原抗体混合物过夜或室温2 h,激酶或磷酸酯酶活性分析建议用2 h室温孵育。12. 加入100 μl Protein A琼脂糖珠来捕捉抗原抗体复合物,4℃缓慢摇动抗原抗体混合物过夜或室温1 h,如果所用抗体为鼠抗或鸡抗,建议加2 μl“过渡抗体”(兔抗鼠IgG,兔抗鸡IgG)。13. 14000 rpm 瞬时离心5 s,收集琼脂糖珠-抗原抗体复合物,去上清,用预冷的RIPA buffer洗3遍,800 μl/遍,RIPA buffer有时候会破坏琼脂糖珠-抗原抗体复合物内部的结合,可以使用PBS。14. 用60 μl 2×上样缓冲液将琼脂糖珠-抗原抗体复合物悬起,轻轻混匀,缓冲液的量依据上样多少的需要而定(60 μl 足够上三道)。15. 将上样样品煮5 min,以游离抗原,抗体,珠子,离心,将上清电泳,收集剩余琼脂糖珠,上清也可以暂时冻-20℃,留待以后电泳,电泳前应再次煮5 min 变性。1.https://www.douban.com/note/679654399/2.http://www.detaibio.com/topics/co-ip-overview.html