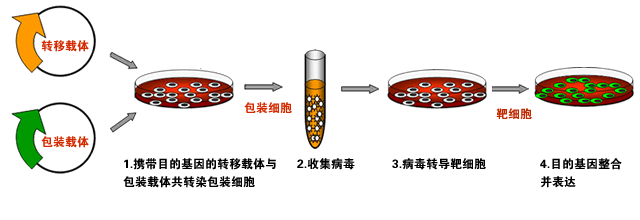
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染。
慢病毒包装系统由一个包装质粒混合物(Mix)和一个慢病毒载体质粒(LentiviralVector)组成,如下图(图片来自MIT):
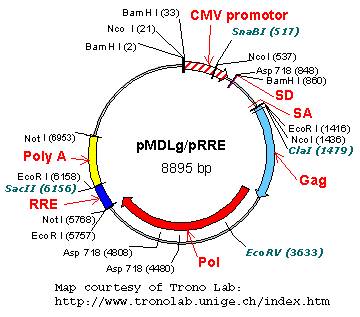
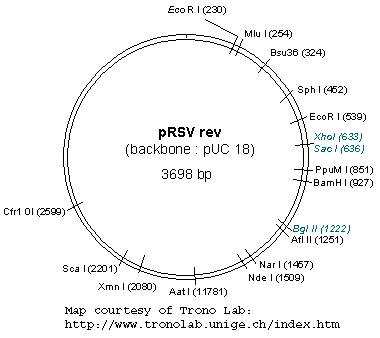
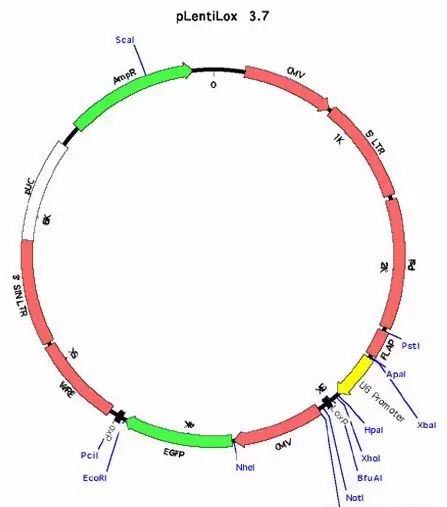
载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件等。
以下介绍用293T细胞在六孔板(35mm)中包装病毒,其他孔板相应增加或减少体积。
☑ 转染试剂:turbofect, 也可以用其它的如lipo2000等。
通过胰酶消化收集细胞,用适当的完全培养基平铺细胞于35mm 培养皿上(根据实验需要选择培养皿,使细胞贴壁后所占面积达到培养皿总面积的80%以上)。将细胞置于含5%CO2的37℃温箱中孵育8-24h,当细胞贴壁完全后即可开始转染。转染前 2h 换液(用1.5ml 完全培养基置换旧的培养基)。
取无菌1.5ml EP管,加入400µl 无血清DMEM,加入1.5µg 核心质粒和1.5µg 病毒包装质粒,及6µl turbofect (turbofect :质粒=2:1),充分混匀,静置15-20min。
将这400μl 的混合液逐滴加入上述单层细胞的细胞培养基中,轻轻摇动平皿混匀后置于含5%CO2的37℃温箱孵育。
6-10 h后吸去培养基,加入2.5ml37℃预热的完全培养基,继续将细胞放置温箱孵育,40h左右可以收集含慢病毒的上清进行感染或者分装后置于-80℃储存待用。(1500rpm离心五分钟,一般可收集到2ml 含病毒上清)
1)将细胞平铺于6孔板或12孔板,最佳密度为30%-70%。
2)对于六孔板:(12孔板减半)
Infectmouse cells:800-1600µl virus + 1600-800 µl fresh medium =2.4 ml total
Infecthuman cells:200-800µl virus + 1200 µl-800 µl fresh medium =2 ml total
3)加入2-5µg/ml polybrene, 充分摇匀后置于37℃温箱孵育。
4)12-24h 后换液,长满后传代或者检测表达,做实验。
在做病毒包装实验中,有科研工作者常遇到:用同样一个病毒载体系统进行病毒包装实验,为什么有人做的很好,次次成功。有人却是时常做不出来,稳定性很差,不是滴度低就是根本不出毒?
腺病毒 or 慢病毒?
慢病毒可以插入细胞基因组,稳定表达,持续时间长。包装周期短(一般要两个月),感染效率相对于腺病毒要低很多。不能扩增,一次包装的病毒用完后如果再需要只能重新包装。一次包装所得到的的病毒滴度也相对较低(10 的 8 次方 pfu/ml),不大适合直接用于动物实验。
腺病毒感染效率高,很多细胞都能达到近 99%。纯化后的腺病毒可以直接进行动物活体注射。可以在体外扩增,每次使用完后,可以自己用包装细胞进行扩增,节约成本。一次包装所得到的滴度较高(纯化后为 10 的 11 次方 pfu/ml,未纯化的为 10 的 10 次方 pfu/ml)。不整合到基因组,无法稳定表达。表达时间相对于慢病毒较短(两三周这样)。包装腺病毒的周期会比慢病毒长一些(一般要两个半月),因为腺病毒包装过程相对较繁琐。
病毒包装的关键点
病毒包装的几个关键节点就是细胞因素、载体系统 (尽量使用成熟的商业化载体系统)、构建重组的质粒正确与否、质粒抽提纯化情况、包装转染控制 (24、48 小时的细胞及荧光状态判断)、目的基因对病毒包装影响 (基因大小、序列情况、蛋白功能毒性等都会影响到是否能包装成功)。
如何提高病毒感染效率
病毒感染效率主要和三方面有关,病毒本身的滴度,目的细胞种类以及个人操作问题。在这里我先把操作问题排除,你若想提高病毒感染效率,可以先提高病毒滴度,在感染的过程中适当的加大病毒感染量或者通过多次加入病毒提高感染率。其次,你也可以加一些辅助感染试剂来提高病毒感染率的,如 polybrene。另外,你要根据不同的目的细胞加入合适的病毒量,这样才能更精确的提高病毒感染效率。
293T 细胞有关
293T 细胞长的比较快,传代时也容易从壁上脱落,不需要怎么吹打,保险起见,在消化时还是要尽量吹打均匀。此外传代时吹打的细胞液,每个平皿里的细胞也要铺的均匀,并要及时换液传代。
293T 细胞包装慢病毒时,转染方法优先选择阳离子脂质体方法。氯化钙法转染效率相对低,出毒效率相对低。且对氯化钙法对 pH 值要求很苛刻,差一点都不行。阳离子脂质体法效果比较好,但常规使用的 Lipo2000 细胞毒性大,有钱的可以使用低毒性的 Fugene HD,钱少的可以选用其他公司的 Lipofiter 阳离子脂质体产品,效率和 Lipo2000 差不多,毒性基本没有。
病毒浓缩有关
病毒一般可以收两次,可以在 48 h 和 72 h 各收一次。如果你不想麻烦浓缩病毒的话,也可以不浓缩,直接将收集的病毒上清作为要感染的细胞的培养基,但是可能效果会不太好。并且一般收病毒时,培养基的营养已经损耗了很多,那样直接培养感染细胞会损害细胞,所以建议还是进行浓缩后再感染。
如何提高腺病毒的活性?
提高腺病毒的活性,关键应该是在病毒包装过程和扩增过程。纯化过程只是去掉有缺陷的病毒和细胞碎片等容易引起机体免疫反应的过程,如果扩增的病毒滴度高,那么纯化后就会更高的。
纯化后病毒如何保存?
纯化后的病毒用无血清的 DMEM 保存就可以了,一般放在 -80 度进行长久保存。如果收集的上清不想立即纯化可先放在 -80 度,等下次收集的一起纯化。目的蛋白在包装细胞中或者滴度测定细胞中会表达的,滴度测定就是根据目的蛋白表达情况来进行操作的。














