炎症性肠病是基因、免疫、饮食、环境等多种因素参与的一种慢性疾病,随着现代生活方式的改变,炎症性肠病已经越来越普遍,炎症性肠病简单的可以分为溃疡性结肠炎(UC)和克罗恩病(CD)两种,其致残率和致死率呈现持续的上升趋势。为了研究相对应的治疗药物,迄今为止科学研究者已经开发出60多种动物模型,主要可以分为以下几类:

今天小虫跟大家分享几种较为常用的炎症性肠病的动物模型。
三硝基苯磺酸(TNBS)诱导的 炎症性肠病
(一)实验动物
本模型可用大、小鼠、兔等实验动物造模,本文小虫主要介绍在小鼠上的造模过程。
8周龄,24 g体重的C57BL/6小鼠
(二)试剂耗材
1、实验试剂
TNBS、橄榄油、无水乙醇、丙酮、1mL注射器、软管(可用胆汁插管的软管)、涡旋仪
2、试剂配制
首先将TNBS溶于水,配制成5%TNBS(w:v)水溶液,然后配制橄榄油与丙酮比例为1:4(v:v)的均匀混合溶液,使用该混合液将5%的TNBS稀释为1%的TNBS溶液(或首先将TNBS溶于水,配制成5%TNBS(w:v)水溶液,然后使用无水乙醇将5%的TNBS稀释为1%的TNBS溶液)。
3、造模
小鼠背部去毛(1.5x1.5 cm),取配制好的1%的TNBS溶液150 μL均匀涂抹在去毛位置,七天后,动物称重并标记,小鼠麻醉后使用1ml注射器通过软管将100 μL的1%TNBS缓慢注射进入小鼠直肠内(软管插入直肠的长度大约4 cm),小鼠倒立保持约1 min,然后将动物放置回笼内,造模后持续观察动物状态,通过DAI评分判定动物成模情况。
噁唑酮(Oxazolone)诱导的 炎症性肠病
(一)实验动物
本模型可用大、小鼠实验动物造模,主要介绍在小鼠上的造模过程。
8周龄,24 g体重的SJL/J小鼠
(二)试剂耗材
1、实验试剂
噁唑酮、橄榄油、无水乙醇、丙酮、1mL注射器、软管(可用胆汁插管的软管)、涡旋仪
2、试剂配制
配制橄榄油与丙酮比例为1:4(v:v)的均匀混合溶液
用水稀释无水乙醇得到50%乙醇
称取一定量的噁唑酮,使用橄榄油/丙酮混合液溶剂,配置成3%的噁唑酮给药溶液或者用50%的无水乙醇配制得到1%的噁唑酮给药溶液。
3、造模
小鼠背部去毛(1.5x1.5 cm),取配制好的1%噁唑酮溶液(50%乙醇溶解)或者3%(橄榄油/丙酮混合液溶解)150 μL均匀涂抹在去毛位置,七天后,动物称重并标记,小鼠麻醉后使用1ml注射器通过软管将100 μL的噁唑酮给药溶液缓慢注射进入小鼠直肠内(软管插入直肠的长度大约4 cm),小鼠倒立保持约1 min,然后将动物放置回笼内,造模后持续观察动物状态,通过DAI评分判定动物成模情况。
双琥珀酰亚胺辛二酸酯(DSS)诱导的 急性炎症性肠炎模型
(一)实验动物
8周龄,24 g体重的C57BL/6小鼠
(二)试剂耗材
1、实验试剂
DSS、水
2、试剂配制
称取一定量的DSS,使用水溶解,配置成2%-5%(w:v)的DSS水溶液,DSS溶液配制好完成后可在4℃避光保存。
3、造模
动物按照体重随机分组后,将动物水瓶内的水溶液更换为DSS水溶液,按照5ml/只*天进行准备,隔两天后更换新的DSS溶液(DSS给药时为day1,在day3、day5更换DSS溶液),第8天将DSS溶液更换为不含DSS的清水。造模后持续观察动物状态,通过DAI评分判定动物成模情况。
1、实验试剂
DSS、水
2、试剂配制
称取一定量的DSS,使用水溶解,配置成2%-5%(w:v)的DSS水溶液,DSS溶液配制好完成后可在4℃避光保存。
3、造模
动物按照体重随机分组后,将动物水瓶内的水溶液更换为DSS水溶液,按照5ml/只*天进行准备,隔两天后更换新的DSS溶液(DSS给药时为day1,在day3、day5更换DSS溶液),第8天将DSS溶液更换为不含DSS的清水,清水摄取持续14天后,重复前面的步骤2-3次,造模后持续观察动物状态,通过DAI评分判定动物成模情况。


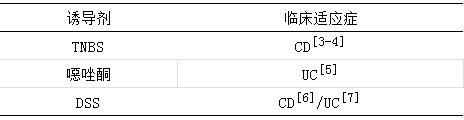
不同的诱导剂对应不同的临床适应症,我们可以根据实验需要、技术能力选择相应的模型,DSS诱导的模型适应与炎症性肠炎的大多数适应症,且此模型操作简单,因此在临床前和临床研究中较为常用,但是此模型的成模率、模型稳定性差。
1、试剂购买时尤为需要注意的是DSS,购买时需购买Da在36000-50000范围内的,国产试剂或者进口试剂均可。
2、软管购买时尽可能选用软管,胆汁插管的管子粗细合适,硬管较为容易插进直肠,软管较为费力。

以上即为几种比较常用的炎症性肠病模型啦,需要的小伙伴抓紧收藏吧,有什么想法也可以跟小虫一起探讨。
顺便提醒一下:肠炎模型除了造模剂之外,有时候跟动物的饲养环境有很大的关系,所以要尽量保证动物的饲养环境哦。
参考文献
[1] Wirtz S, Neufert C, Weigmann B, Neurath MF. Chemically induced mouse models of intestinal inflammation. Nat Protoc. 2007;2(3):541-6. doi: 10.1038/nprot.2007.41. PMID: 17406617. [2] Wirtz S, Popp V, Kindermann M, Gerlach K, Weigmann B, Fichtner-Feigl S, Neurath MF. Chemically induced mouse models of acute and chronic intestinal inflammation. Nat Protoc. 2017 Jul;12(7):1295-1309. doi: 10.1038/nprot.2017.044. Epub 2017 Jun 1. PMID: 28569761. [3] Neurath, M., Fuss, I., Kelsall, B., Stuber, E., & Strober, W. (1995). Antibodies to interleukin 12 abrogate established experimental colitis in mice. Journal of Experimental Medicine, 182, 1281– 1290. [4] Kiesler, P., Fuss, I.J. & Strober, W. Experimental models of inflammatory bowel diseases. Cell. Mol. Gastroenterol. Hepatol. 1, 154–170 (2015) [5] Boirivant, M., Fuss, I., Chu, A., & Strober, W. Oxazolone colitis: A murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. Journal of Experimental Medicine, 188, 1929–1939. (1998) [6] Hartmann, G., Bidlingmaier, C., Siegmund, B., Albrich, S., Schulze, J., Tschoep, K., Eigler, A., Lehr, H. A., & Endres, S. Specific type IV phosphodiesterase inhibitor rolipram mitigates experimental colitis in mice. The Journal of Pharmacology and Experimental Therapeutics, 292, 22– 30. (2000) [7] Okayasu, I. et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology 98, 694–702 (1990).














