成功冻存细胞和复苏细胞是细胞培养研究的两个重要方面,细胞本身的特性和细胞低温储藏时防止冰晶形成是维持细胞活力的关键。
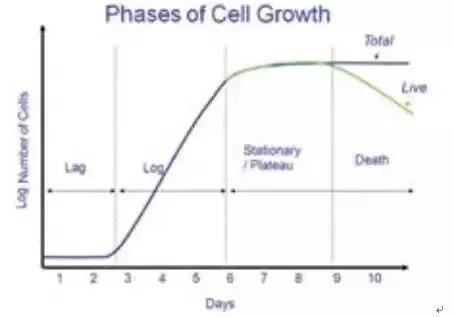
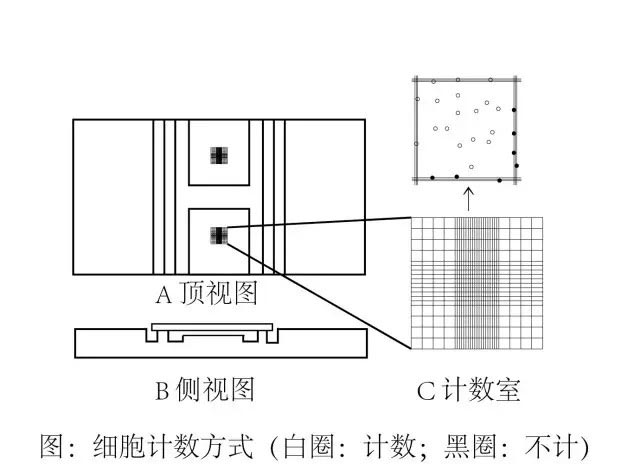
1.冻存“年轻力壮”的细胞 为保证细胞在复苏后,有良好的增殖能力,建议冻存传代三代以内的细胞。俗话说得好,年轻人的恢复能力是杠杠滴!细胞亦是如此~ 2.在冻存之前一定要先了解清楚该细胞的增殖呢李并冻存适当数量的细胞 每种细胞的增殖能力各不相同,知己知彼才能百战不殆。如果增殖能力不高,可以在冻存细胞时,用10%-90%的血清(多数常见细胞株可用20%)维护细胞活力,并且提高每份冻存的细胞数量。 通常,冻存液中细胞的最终密度为5×106/mL~1×107/mL。如同美食和闺蜜使我心宽体胖,细胞也需要充足的营养和同伴的互相扶持才能茁壮成长。 3.细胞冻存一定要缓慢降温 DMSO可保护细胞免受冰晶导致的机械损伤,一般用培养液配制10% DMSO作为冻存液。 但是如果降温迅速,即使有DMSO的保护,也可能会产生少量冰晶损伤细胞。 因此,可将加入冻存液的细胞悬液放入程序降温盒保存至-80℃过夜,缓慢降温(若没有程序降温盒,可以先在4℃冰箱放置30 min,然后转移至-20℃放置1-2 h,最后转移至-80℃过夜),第二天取出并放入液氮罐中长期保存。 4.细胞复苏需快速融化 必须将冻存的细胞快速融化至37℃(不要超过5min),使细胞外冻存时的冰晶迅速融化,避免冰晶缓慢融化时进入细胞形成再结晶,对细胞造成损害。刚刚复苏的细胞就像刚出生的Baby,整个操作过程需要轻柔缓和。 细胞冻存前需要做细胞计数以保证冻存适当数量的细胞,那么怎么进行细胞计数呢?请看下文: 确保充分的细胞生长是细胞培养和收集精确数据的一个关键部分。对于单层生长的细胞,融合度定义为显微镜观察到被一层细胞覆盖的培养器皿表面积的百分比。比如,50%细胞融合是指一半的培养皿/瓶等的表面被细胞覆盖。对于悬浮细胞,通常用细胞系或类型的细胞密度衡量其生长过程,但或许也可通过浊度增加和培养基颜色稳定评估“融合“。 培养中的细胞生长一般发生在四个阶段,如图所示,随着时间推移的细胞计数的对数形成一个S型曲线(S-型),不同细胞系和培养物在每个阶段需要的时间有很大差异。 停滞期:细胞适应培养条件的阶段,细胞在此阶段不分裂。细胞通常在起始培养后的24小时内附着,该阶段的总时长取决于培养之初使用细胞的生长阶段和接种密度。 对数期:细胞在此阶段积极分裂,是评估群体生长和通用数据收集的最佳时间。对数期的后期,过度拥挤导致细胞胁迫之前是传代细胞(亚培养)的最佳时机。 平稳期:随着细胞达到100%融合,细胞在此阶段生长放缓,不足1/10的细胞处于活跃细胞周期。细胞在此阶段最容易受伤,因此需要小心观察以确保细胞在此阶段之前或之初进行传代。 衰退期:细胞周期的自然组成部分。在此阶段,随着细胞死亡占据主导地位,活细胞群体数量减少。 细胞计数 在细胞培养工作中,常需要了解细胞生活状态和鉴别细胞死活,确定细胞接种浓度和数量以及了解细胞存活率和增殖度,如用酶消化制备的细胞悬液中细胞活力的鉴别,冻存细胞复苏后的活力检测等。细胞悬液制备后,常用活体染料台盼蓝对细胞进行染色,进行细胞计数。台盼蓝不能透过活细胞正常完整的细胞膜,故活细胞不着色。而死亡细胞的细胞膜通透性增高,可使染料进入细胞内而使细胞着色(蓝色)。准确的细胞计数对评估培养的细胞生长是至关重要,因为错误的计数会导致关于细胞健康的错误结论。细胞计数可以使用血球计数板、自动计数器进行。细胞计数一般用血细胞计数板,按白细胞计数方法进行计数,便于确定细胞的生活状况。 1、所需物品 0.4%台盼蓝溶液 无水乙醇或95%乙醇溶液 脱脂棉 相差显微镜 试管、吸管、毛细吸管 细胞计数板 2、方法 1. 将动物细胞用PBS制备成适当浓度的细胞悬液备用。 2. 用无水乙醇或95%乙醇溶液擦拭计数板后,用绸布擦净,另擦净盖玻片一张,把盖片覆在计数板上面。 3. 用滴管吸取0.4%台盼蓝染液,按1∶1比例加入细胞悬液中。从计数板边缘缓缓滴入,使之充满计数板和盖片之间的空隙中。注意不要使液体流到旁边的凹槽中或带有气泡,否则要重做。稍候片刻,将计数板放在低倍镜下(10×10倍)观察计数。 4. 按图计算计数板的四角大方格(每个大方格又分16个小方格)内的细胞数。计数时,只计数完整的细胞,若聚成一团的细胞则按一个细胞进行计数。在一个大方格中,如果有细胞位于线上,一般计下线细胞不计上线细胞,计左线细胞不计右线细胞。二次重复计数误差不应超过±5%。镜下观察,凡折光性强而不着色者为活细胞,染上蓝色者为死细胞。 5. 计完数后,需换算出每ml悬液中的细胞数。由于计数板中每一方格的面积为0.01cm2,高为0.01cm,这样它的体积为0.0001 cm3,即0.1 mm3。由于1ml=1000 mm3,所以每一大方格内细胞数×10,000=细胞数/ml,故可按下式计算: 细胞悬液细胞数/ml=4个大格细胞总数/4×10,000 6. 如计数前已稀释,可再乘稀释倍数。 7. 计数细胞后,计算细胞悬液浓度并求出存活与死亡细胞数的比例。 3、注意事项 1. 向计数板中滴细胞悬液时要干净利落,加量要适当,过多易使盖片漂移,或淹过盖片则失败,需重做;过少易出现气泡;不理想时,应重做; 2. 镜下计数时,若方格中细胞分布明显不均,说明细胞悬液混合不均匀,需重新将细胞悬液进行混合,再重新计数。 3. 计数时,对于位于边线或交界处的细胞/细胞团,遵循“计上不计下,计左不计右”的规则; 4. 一个细胞团计做一个细胞。 附:细胞活力的测定方法 1、将细胞悬液以0.5ml加入试管中。 2、加入0.5ml 0.4%台盼兰染液,染色2一3分钟。 3、吸取少许悬液涂于载玻片上,加上盖片。 4、镜下取几个任意视野分别计死细胞和活细胞数,计细胞活力。 死细胞能被台盼兰染上色,镜下可见深兰色的细胞,活细胞不被染色,镜下呈无色透明状。 活力测定可以和细胞计数合起来进行,但要考虑到染液对原细胞悬液的加倍稀释作用。 MTT法测细胞相对数和相对活力 活细胞中的琥珀酸脱氢酶可使MTT分解产生兰色结晶状甲赞颗粒积于细胞内和细胞周围。其量与细胞数呈正比,也与细胞活力呈正比。 l、细胞悬液以1000rpm离心10分钟,弃上清液。 2、沉淀加入0.5-1ml MTT,吹打成悬液。 3、37℃下保温2小时。 4、加入4—5 ml酸化异丙醇(定容)。打匀。 5、1000 rpm离心,取上清液酶标仪或分光光度计570nm比色,酸化异丙醇调零点。 注意:MTT法只能测定细胞相对数和相对活力,不能测定细胞绝对数。