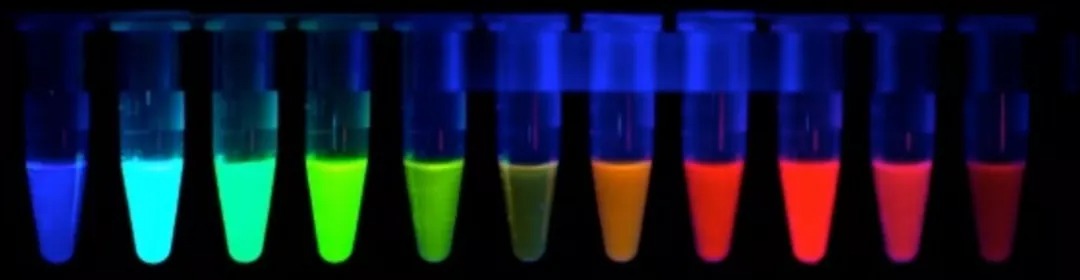
好看的各种荧光蛋白
荧光蛋白是分子生物学研究中的重要工具,在实验室中,一个普通的本科生经过科研训练就可以表达发出漂亮荧光的蛋白。尽管科学家们一直对荧光蛋白进行改造来开发出更多的生物学工具,但仍然面临着许多问题。那么接下来,我们来一起看一下荧光蛋白的发展历史吧。
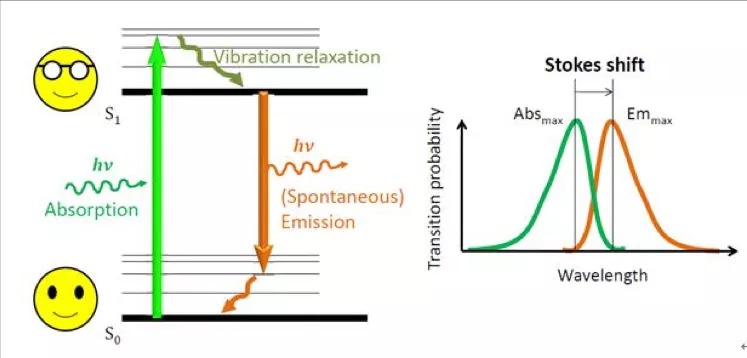
荧光的原理:电子吸收能量从基态跃迁至第一电子激发态,通过内转化的方式到达第一电子激发态的最低态,之后跃迁至基态,以光的形式释放能量,产生荧光。由于激发和发射之间能量的损耗,因此,发射波长比激发波长更长。
在许多方面,荧光是一种来监控细胞内信号通路行为的理想工具,主要突出特点有1:荧光快速:荧光团对光的吸收和发射发生在纳秒级;2:空间精确:发射波长小于许多细胞结构,是用来成像的优秀工具。
▉ 经典之绿色荧光蛋白
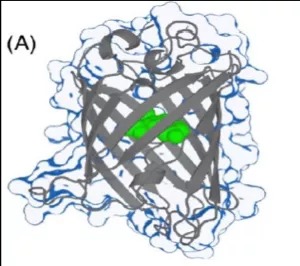
绿色荧光蛋白的发色团及β桶结构
绿色荧光蛋白GFP是第一个被发现的荧光蛋白,来源于水母Aequorea victoria。GFP分子量约为27kDa,是一个由238个氨基酸组成的单链多肽。最大激发波长395nm,发射峰509nm,并且在470nm处有一个肩峰。其化学性质稳定,作为荧光标记广泛应用于生物医学研究。
其发色团由65至67位的三个氨基酸(Ser-Tyr-Gly)残基组成,包裹在一个β折叠形成的桶装结构中。当蛋白质链折叠时,这段被深埋在蛋白质内部的氨基酸片段经环化,脱水形成咪唑酮。在分子氧存在的条件下,发色团可进一步发生氧化脱氢,最终形成荧光。简单来讲,66位酪氨酸的六元苯环与蛋白质主链环化形成的双环共轭结构可以发光。
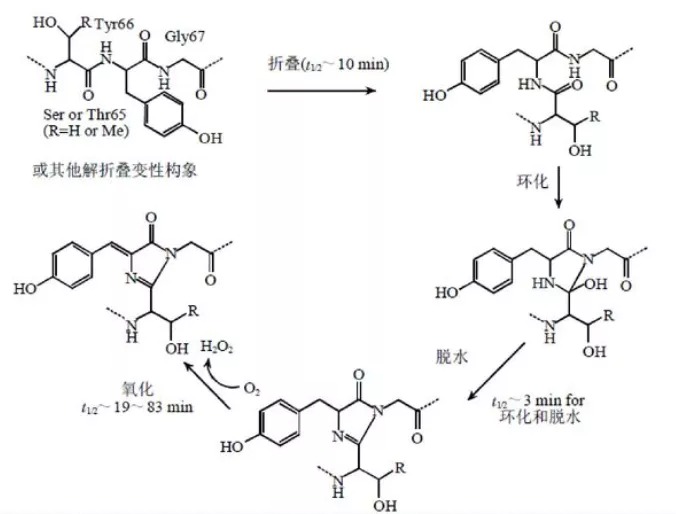
绿色荧光发光机理
GFP需要在氧化状态下产生荧光,强还原剂或者酸性条件能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧气中,GFP荧光便立即得到恢复。只需要氧气作为底物便可以发光,不需要任何外源反应底物,这也是GFP得到大量应用的原因。
▉ 各种颜色荧光蛋白的开发

2008年诺贝尔化学奖得主
从1994年到1999年,人们只克隆了一种荧光蛋白——维多利亚的绿色荧光蛋白(GFP)。但是科学家并不满足于此,因此进行大量努力来创造不同颜色的绿色荧光蛋白变种,因为共轭结构是荧光蛋白发色的关键,对发色团进行点突变产生了以Phe、His或Trp取代Tyr66的蓝色和青色突变体荧光蛋白;利用关键突变T203Y得到了激发发射最大值为515 529 nm的黄色突变体荧光蛋白。工程化改造的另一个目标是开发出更加明亮的荧光蛋白,荧光蛋白越亮,细胞内的浓度就越低,相比起背景,荧光亮度高,信噪比高,可以用于高灵敏度的对比成像。在绿色荧光蛋白改造过程中,美籍华人钱永健(Roger Tsien)做出了巨大的贡献,开发出更亮的性质更稳定的GFP,通过解析发光原理开发出了具有丰富色彩的荧光蛋白。他因此与下村修(绿色荧光蛋白的发现者),Martin Chalfie(将绿色荧光蛋白应用于生物样品标记)共享了2008年的诺贝尔化学奖。目前生物实验室普遍使用的荧光蛋白大部分都是钱永健改造之后的变种。

荧光蛋白的开发年鉴
▉ 诱人的红色荧光蛋白
在开发不同荧光的过程中,由于红色荧光的诸多优点(下面会介绍),学术界和产业界在产生红色荧光突变体蛋白领域做出了巨大的努力,很久的一段时间里,没有人在GFP的基础上开发出进一步的红移且最大发射波长超过529 nm的GFP突变体。1999年,俄罗斯科学家通过与水母(Aequorea)的绿色荧光蛋白(GFP)同源的Discosoma珊瑚中克隆出一种红色荧光蛋白DsRED。该蛋白比GFP更大,但是,钱永健设法减小了DsRED的大小。他还从DsRED开发了一系列具有诱人名称的红色蛋白,例如mPlum,mCherry,mStrawberry,mOrange和mCitrine。
研究显示,DsRED蛋白在成熟时,最大激发发射波长由未成熟的类似GFP的475nm/500nm红移至558nm/583nm。推测其发光机理与GFP类似,在形成一个初步的对羟基苯咪唑啉酮的共轭结构后,α-C与66位的Gln的N之间脱氢,在咪唑环的2位形成了—C=N—C=O ,可以进一步扩展发色团,从而实现由绿到红的转变。
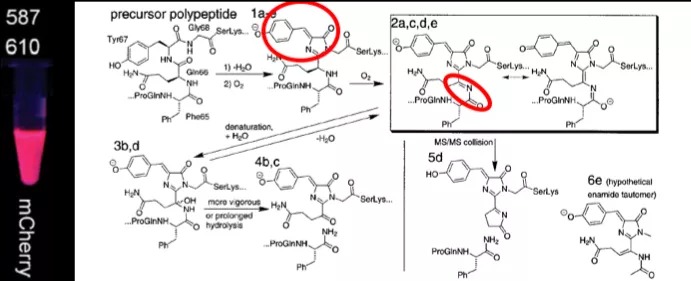
mCherry蛋白以及钱永健推测的DsRED发光团形成机理
此外,基于荧光蛋白衍生出了多种工具,其中得到广泛应用的就是荧光生物感受器,通过荧光有无或者荧光颜色的转变来实现对生物体内不同状态以及不同信号分子的反应,已经得到了广泛的发展。目前已经发展出了多种生物传感器,但是仍然以黄绿荧光为主。如果可以开发出一种可以实现绿红转变的通用策略,那么将会极大拓展荧光生物感测器的范围。科学家们痴迷于改造荧光蛋白使它们发出不同颜色的光,一方面是为了成像的丰富性,另一方面不同颜色在成像方面更是有各有所长。其中红色荧光在研究中是最有用的。
红色荧光的优点:
1. 较低的自发荧光和光毒性。光毒素是具有共轭系统(通常是芳香系统)的分子。它们具有较低的激发态,可以通过用可见光光子激发来实现。这种状态会与组织中的相邻分子发生系统间交叉,从而将它们转化为有毒的自由基,它们迅速攻击附近的分子,杀死细胞。红色荧光的激发态更高,不容易被可见光光子激发。
2. 较强的组织穿透性。波长在650 - 900纳米之间的长波光穿透动物组织最远,因为组织吸收(即来自血红蛋白、水和脂质)和光散射的综合效应最小。
因此,红外FPs (IFPs)作为蛋白质标签和体内成像应用是首选。
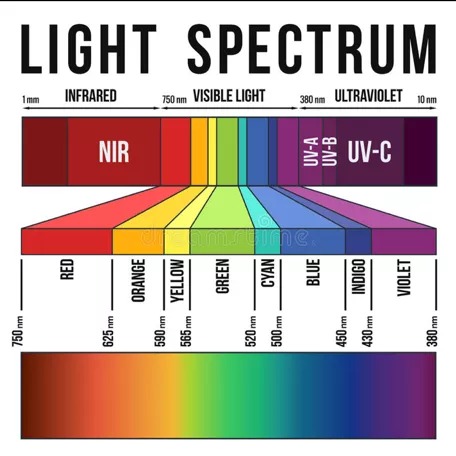
光谱图
由于红色荧光的优越性质,研究者一直想改造出一个基于GFP的红色荧光蛋白。不仅为了拓展分析的范围,也为了改进其性质。
一种思路是维持发色团的稳定状态。细胞的表观亮度高度依赖于外在的环境条件。因此,许多策略的目标都是通过优化密码子的使用,促进蛋白质折叠,促进染色质成熟的程度和速度,以及通过降低pH和O2等环境干扰的影响来提高蛋白质的稳定性。一些实验当中为了维持发色团的稳定状态需要特殊的环境条件,例如厌氧条件,紫外线照射,或者蓝光照射或者给予额外的电子受体。由于对环境条件的要求高,这种策略很容易出现只有部分的绿-红转变的现象。
另一种思路是对发色团的氨基酸进行改造。例如插入含有不同结构的非天然氨基酸来调控发色团的结构。比如有人通过插入一个色氨酸类似物实现了由绿色向金色的转变。另一些非天然氨基酸则可以实现荧光对不同条件的响应。但是种种努力都有一个共同的局限性:这些策略都有高度的特异性,只能针对性地一个一个进行设计,没有一个通用的策略可以实现类GFP蛋白的由绿到红的转变。
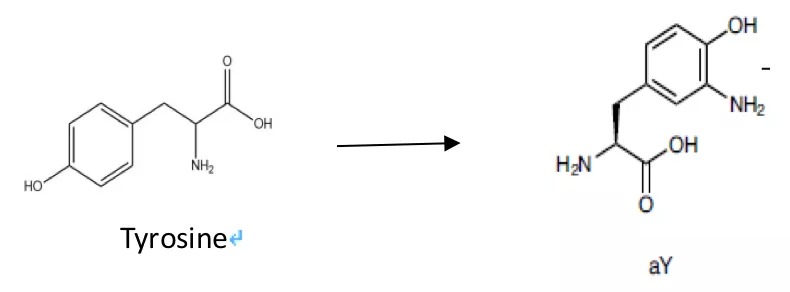
最近,来自弗吉尼亚大学的HuiWang Ai研究员在对GFP改造来开发新的生物传感器的过程中,偶然发现了一种酪氨酸类似物aY , 以密码子拓展技术将其插入到GFP类蛋白的发色团中时,可以实现自发且高效的由绿到红的转变。他们尝试在一些常用的荧光生物感受器中插入aY ,结果都发现其荧光发生了明显的红移,并且在很大程度上保留了其原本的亮度以及生物学性质。
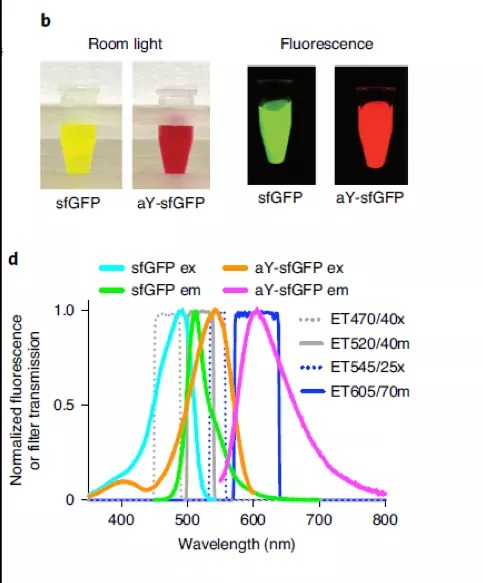
经过aY改造后的sfGFP实现了明显的红移
aY与酪氨酸相比,仅在酚羟基的邻位增加了一个氨基,为何能实现发色团的红移呢?参照DsRED的发光机理,他们推测了aY参与的发色团形成过程:与GFP的发色过程类似,首先经过氧化环化形成了一个苯环与吡啶内酮的结构,之后,发生进一步的氧化,邻位的氨基离去质子触发了共轭结构内的电子转移,形成了C=N—C=O 延长了共轭结构实现了发色团的红移。
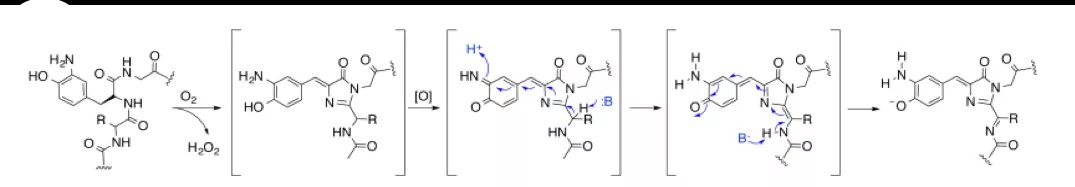
推测的aY参与形成发色团的过程
以往对于发色团的改造更多地集中在对于参与形成吡啶环的氨基酸改造上,偶然的发现这项工作选择在苯环上进行改造,非常巧妙地实现了共轭结构的扩大,也给未来针对发色团改造的研究提供了新思路。所以大家在进行科学研究时,也不要放过实验中的任何小细节,说不定伟大的发现就蕴含在这些不起眼的细节当中。
参考文献:
1. Rodriguez, E. A. et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends Biochem. Sci. 42, 111–129 (2017).
2. Greenwald, E. C., Mehta, S. & Zhang, J. Genetically encoded fluorescent biosensors illuminate the spatiotemporal regulation of signaling networks. Chem. Rev. 118, 11707–11794 (2018).
3. Mishin, A. S. et al. The first mutant of the Aequorea victoria green fluorescent protein that forms a red chromophore. Biochemistry 47, 4666–4673 (2008).
4.Liu, C. C. & Schultz, P. G. Adding new chemistries to the genetic code. Annu. Rev. Biochem. 79, 413–444 (2010).
5.Gross, L. A., Baird, G. S., Hoffman, R. C., Baldridge, K. K. & Tsien, R. Y. The structure of the chromophore within DsRed, a red fluorescent protein from coral. Proc. Natl Acad. Sci. USA 97, 11990–11995 (2000).
6.Zhang S, Ai HW. A general strategy to red-shift green fluorescent protein-based biosensors. Nat Chem Biol. 2020 Sep 14. doi: 10.1038/s41589-020-0641-7. Epub ahead of print. PMID: 32929278.














