治疗性mAb通过不同的机制诱导抗肿瘤作用,这些机制分别取决于靶抗原、靶细胞的性质,以及mAb的Fab和Fc区域与靶抗原和效应细胞之间相互作用的性质。对治疗性mAb的作用机制的了解对后期的患者选择、疾病设定和联合治疗等方面具有指导意义。本文就治疗性抗体抗肿瘤作用机制做一个简单的介绍。
1. 靶抗原的功能中和作用
针对肿瘤细胞或TME的非肿瘤细胞的治疗性mAb主要识别生长因子受体或其配体、血管生成受体及其配体以及免疫检查点分子。这些mAb的抗肿瘤活性依赖于靶抗原在肿瘤细胞上的表达水平和持续水平。这些mAb通过构象变化,引起空间位阻或促进细胞表面受体的内化和下调,进而中断下游信号(图1A和B)。
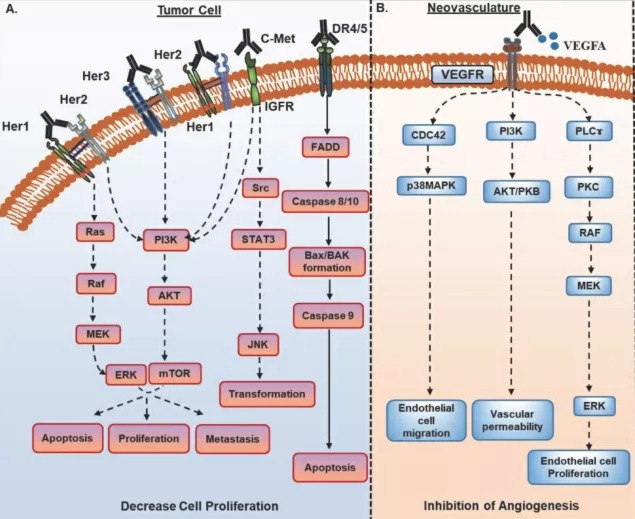
图1. 针对生长因子受体或配体以及血管生成受体及其配体的mAb抗体作用机制
大多数针对生长因子受体的mAb靶向受体酪氨酸激酶(RTK)家族,如EGFR、HER2、HER3和c-met等,这些mAb目前已被批准用于不同的癌症,包括转移性结直肠癌(CRC)、非小细胞肺癌(NSCLC)和鳞状细胞癌(SCC)。目前已有几种针对EGFR的mAb被批准用于临床,其中西妥昔mAb被广泛用于单独使用或与化疗或放疗联合使用。同样,针对HER2和HER3的mAb对HER2阳性的乳腺癌和肺癌患者非常有效。尽管针对生长因子受体EGFR和HER2的治疗性mAb已显示出良好的效果,但由于肿瘤的遗传和病理生理特征而出现了多种耐药机制,其疗效可能会受到影响。一些临床试验正在评估针对不同受体的mAb组合,以解决耐药性问题。
在针对血管系统的mAb中,贝伐单抗(VEGF)是第一个被批准临床用于转移性大肠癌患者的抗血管生成剂,此后,Ramucirumab(VEGFR1)获得批准用于各种恶性肿瘤。此外,针对其他生长因子受体的mAb,包括c-met、Ang-1、Ang-2和IGF-1R正在进行临床试验。
在过去的十年中,针对免疫检查点分子的治疗性抗体(ICB)(图2)已经占据了癌症免疫治疗的中心舞台。自从2010年抗CTLA4 mAb ipilimumab被批准用于晚期无法切除的黑色素瘤以来,针对免疫检查点分子的抗体已经被批准用于几种恶性肿瘤。针对另一检查点分子PD-1或其配体PD-L1的单克隆抗体在逆转免疫衰竭方面取得了显着的成功。2014年,两种抗PD-1抗体pembrolizumab(Keytruda)和nivolumab(Opdivo)获得FDA批准,用于治疗各种癌症,包括转移性黑色素瘤、非小细胞肺癌和肾癌。其他针对不同检查点分子的mAb,如LAG-3或CD223、Vista和TIM3也在研究中。
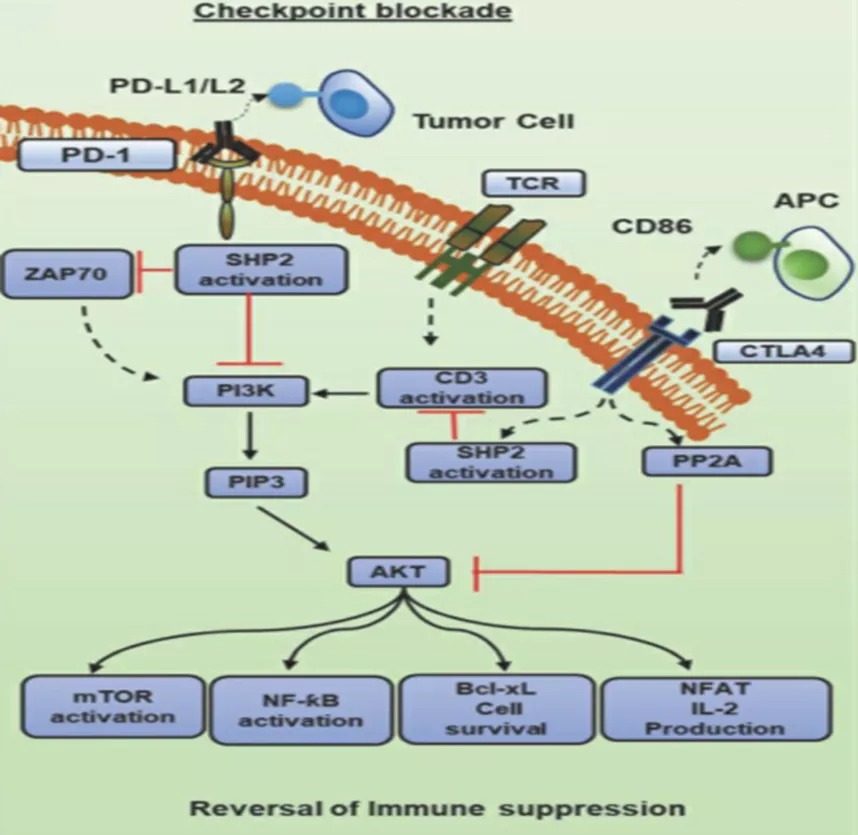
图2. 针对免疫检查点的mAb抗体作用机制
2. 与效应细胞接合
治疗性mAb分别通过其抗原结合域(Fab)和Fc结构域将肿瘤细胞和免疫系统的效应臂交联,并引发一系列效应功能。这包括通过中性粒细胞和自然杀伤(NK)细胞诱导抗体依赖性细胞毒(ADCC),通过巨噬细胞诱导抗体依赖性细胞吞噬(ADCP),以及通过免疫系统的补体途径诱导补体依赖性细胞毒作用(CDC) (图3)。这里不再详细介绍。
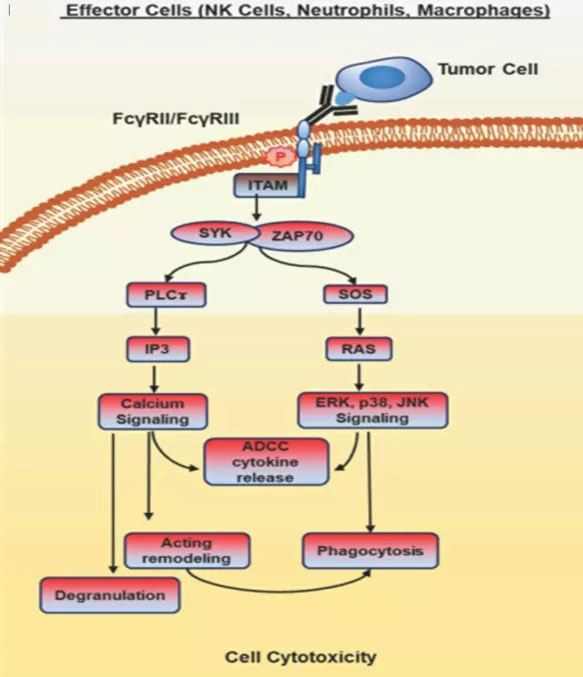
图3. 与效应细胞接合的mAb作用机制
3. 抗体-药物结合物(ADC)
mAb具有特异的靶向性和稳定性的能力推动了ADC的开发,用于将细胞毒有效载荷运送到肿瘤部位,并克服了与化疗相关的毒性问题。ADC通过特异性地与肿瘤细胞结合、通过受体介导的内吞作用内化、内小体形成以及与溶酶体融合来发挥其活性。在丰富的内环境中,ADC裂解和细胞毒性有效载荷的释放,从而阻碍复制机制或微管组装,致使随后的细胞死亡(图4)。ADC的成功开发也面临着一些挑战,包括靶抗原的选择、mAb的特异性和亲和力、循环中有效载荷的效力和稳定性以及接头的选择。在过去的十年中,通过选择更好的细胞毒剂、生物偶联方法、更好地选择靶向抗原和抗体工程优化,ADC得到了长足的进步。目前,已有9个ADC已获批准,其中有5个在19和20这两年获得批准,另外有80多个正在进行积极的临床研究。
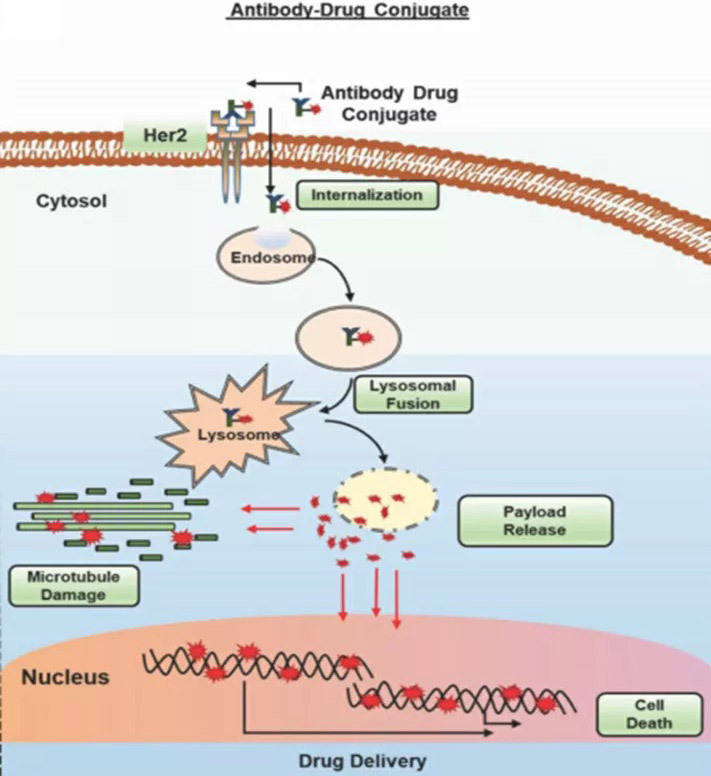
图4. ADC作用机制
4. 放射免疫治疗
放射免疫治疗(RIT)利用抗体以抗原特异性的方式靶向肿瘤的能力,选择性地输送治疗性放射性核素并局部释放细胞毒性电离辐射(图5)。RIT可将电离辐射靶向显性和隐匿性病变,并已成功地用于治疗血液系统恶性肿瘤。然而,由于几个因素,包括肿瘤细胞的固有放射抗性、缺氧的TME和放射性标记mAb的长循环半衰期,导致剂量限制性的骨髓毒性,这一成功并未在实体肿瘤中重演。尽管如此,各种方法已经被用来提高RITs治疗实体肿瘤的疗效。这些方法包括靶抗原选择标准、mAb药代动力学与放射性核素衰变特性之间的相容性、给药途径、使用生物反应调节剂以增强递送。越来越多的证据表明,RIT的治疗指数可以通过联合放射增敏剂、化疗或手术协同增强。该领域的最新进展是FDA批准Y-mAbs公司的靶向B7-H3的抗体-放射性同位素偶联物177Lu-omburtamab-DTPA的新药研究申请(IND), 用于治疗髓母细胞瘤。
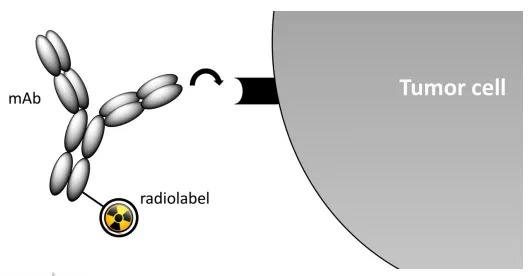
图5. 放射免疫治疗作用示意图
总结
在过去的十年里,基于mAb的抗癌治疗取得了显著的进展,这是由于分子工程的不断创新,以及在靶标生物学方面积累了广泛的知识。然而,目前知道哪种机制在特定恶性肿瘤的临床方案中是有效的仍然是一个挑战, 为此,一些临床试验正在评估基于mAb鸡尾酒或其与化疗、放疗或细胞因子的联合治疗(图6),旨在提高治疗指数,提高患者的生存率。未来进一步了解并解开限制mAb介导的癌症治疗效果的错综复杂的机制将有助于设计新的策略和新的治疗途径,从而有针对性克服耐药性,提高mAb治疗在临床上的有效性。
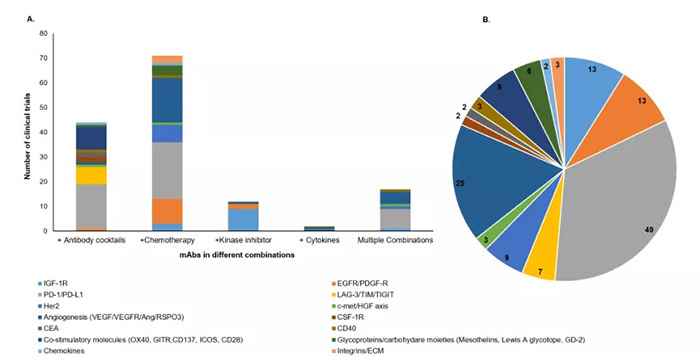
图6.基于mAb的组合靶向的临床试验
参考文献
1. The Current Landscape of Antibody-based Therapies in Solid Malignancies.
2. Antibody–Drug Conjugates: The Last Decade.
文章来源:生物制药














