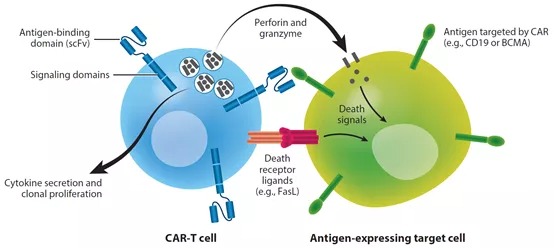
传统药物有清晰的化学成分,且相对稳定,可以设定结构、纯度、效力等参数进行表征。CAR-T细胞本身是活体,是每时每刻都在发生改变的异质性细胞混合物。CAR-T细胞中主要有CD8+T细胞和CD4+T细胞两个群体,CD8+T细胞是执行肿瘤细胞杀伤的效应群体,释放穿孔素和颗粒酶,或者表达FasL通过凋亡通路清除肿瘤细胞。CD4+T细胞,主要是通过释放细胞因子辅助活化CD8+T细胞。
CAR-T多通过流式细胞术进行细胞类别及数量检测,来表征纯度。但是不可能完全解析免疫细胞混合物的异质性,更不用说哪些细胞是外来的,哪些细胞是有效的,哪些细胞是有害的。
CAR-T细胞是由每个病人的自体T细胞制成,起始细胞来源质量及异质性差异显著,阻碍终产品进行批间一致性评价。
CAR-T需要通过载体(γ逆转录病毒载体、慢病毒载体或非病毒转座子系统)将基因转入T细胞,会产生基因随机插入基因组的不确定性,也因此会改变细胞的表型,产生不确定的异质性。
功能实验,比如IFN-γ释放水平,作为潜在的效力检测实验。但是有研究显示tisagenlecleucel(Kymriah)临床疗效和体外IFN-γ释放实验没有太多的相关,细胞因子释放水平和细胞毒性效力没有明显相关性。临床疗效很多来自于注射细胞的子代细胞而非注射的细胞本身。因而临床疗效更多来自于复制能力强的记忆细胞亚群,这群细胞细胞毒性效应功能并不是很强。终产品中CD27+CD45RO−CD8+ T记忆性T细胞亚群与疗效相关性更强。现在一种工艺,将CD4+T细胞和CD8+中枢记忆T细胞,分别进行CAR修饰,终产品中将二者1:1混合。
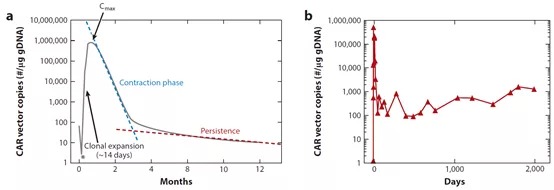
CAR-T 细胞在体内遇到肿瘤抗原会增殖,有些记忆亚群,可以在体内存活很多年。这些特点和传统化合物药物不同。已经上市的tisagenlecleucel (Kymriah),和Axicabtagene Ciloleucel(Yescarta)在体内有类似的动力学规律。7-14天经过克隆扩增,数量达到峰值,之后有一个缩减期,直至3个月左右,最后一部分记忆性亚群,可能会在体内留存数年时间。
*使用流式细胞术进行细胞数量分析,qPCR进行CAR载体拷贝数分析。CAR-T体内药代动力学(文献1)
CAR-T 中的共刺激因子,CD28和4-1BB为主。CD28促进增殖,效应功能,尤其是细胞因子的产生。4-1BB促进CAR-T体内的存活和延长留存时间更强。
病人样本中T细胞亚群特征影响T细胞动力学和长时间存留。一些临床前研究数据显示,T细胞样本中的Naïve T细胞,干细胞记忆T细胞,中枢记忆T细胞有最好的留存特征。
和B系急性淋巴细胞白血病(B-ALL)相比,tisagenlecleucel在弥漫大B细胞淋巴瘤(DLBCL)的血液峰值数量低,但是存留时间更久。原因DLBCL CAR-T更多进入组织,而B-ALL更多在血液中,所以血液中峰值浓度低,但是在组织中留存时间更久。
肿瘤负荷
肿瘤负荷通常报道和CAR-T体内扩增呈正相关。但也不完全如此,如CD19-CAR-T体内扩增并不与肿瘤负荷相关,而与骨髓中CD19+T(肿瘤和非肿瘤均有)相关,所以准确应该是CAR-T与可以接触的抗原表达细胞数量相关。有限数据显示CAR-T细胞动力学不受患者性别、年龄、种族、体重、肿瘤细胞遗传学、疾病分期或者以前治疗的影响。
病人接受CAR-T治疗之前的化疗清淋,可以提高T细胞扩增的峰值,可能原因是宿主淋巴细胞清除,减少了对于有限的细胞因子(IL-7,IL-15)的竞争结合。也有一些研究显示,清淋对于CAR-T体内扩增影响不大。
和传统药物不同,起始输注剂量和体内的代谢动力学并不是完全相关的,因为CAR-T进入体内结合抗原,会产生数量级的扩增。
现在研究显示,CAR-T效应与病人种族、性别、年龄、端粒长度、先前治疗的数量和类型等无明显相关性。
靶细胞上靶抗原的密度与CD19 CAR-T,BCMA CAR-T的疗效也没有明显相关。CAR-T只需要少量的靶抗原就可以被激活。这一点与抗体治疗不同。
目前研究显示,CAR-T细胞体内扩增能力以及留存能力与有效性的相关性最好。CAR-T注射剂量和有效性的关系也不显著,但有几个研究显示BCMA CAR-T治疗多发性骨髓瘤起始剂量和临床结果呈正相关。
终产品中D27+CD45RO−CD8+ T记忆性T细胞和疗效呈正相关,而LAG3-high/TNF-α-lowCD8+ T细胞与治疗失败相关。
原发耐药
1.缺乏CAR-T细胞浸润到肿瘤局部及扩增
2.肿瘤凋亡受体缺失。虽然穿孔素和颗粒酶是CAR-T效应的主要因子,但是Fas等凋亡受体在肿瘤细胞表达下降,也会产生耐药。
继发耐药
继发性耐药最常见于小儿和青年成人B-ALL患者,临床反应率高(>80%),疾病复发率也高(∼40%)。
1. CAR-T持久性差
2. 肿瘤抗原丢失
免疫细胞治疗产品临床试验技术指导原则
(征求意见稿)
药代动力学(PK)
免疫细胞治疗产品的药代动力学特点与传统的小分子或生物大分子药物有明显差异,可能无法进行吸收、分布、代谢和排泄(ADME)等传统药代动力学评估。由于检测技术的快速发展,申请人应利用科学合理的药代动力学评估方法,监测细胞活力、增殖/分化、致瘤性、免疫原性、体内分布、异位灶、组织嗜性/迁移以及细胞/产品预期存活期内的功能等特性。如果一种方法不能完全反映细胞在体内的PK特性,建议申请人采用多种方法监测细胞在体内的增殖和存活情况,例如,对于经过基因修饰的免疫细胞治疗产品如CAR-T,采用实时荧光定量聚合酶链式反应(qPCR)和流式细胞术(Flowcytometry)进行PK分析,分别通过测定外源基因拷贝和CAR+细胞数量的变化,有助于互相验证检测方法的可靠性,可以更全面的分析产品在体内的扩增和存活情况。
药效学(PD)
对于大多数免疫细胞治疗产品,可以通过细胞和/或体液免疫应答分析药效学活性。有多个特异性靶点的治疗产品,应分析其对每个靶点的作用活性。如果细胞经体外基因修饰,在体内分泌特定蛋白、多肽或其它活性成分,或敲除了特定基因的表达,也需要进行针对性的药效学分析,如检测特定蛋白的活性、持续时间和变化情况等。申请人可以基于总体临床研究规划考虑早期探索性研究的设计,在早期研究中纳入有助于未来产品研发的设计要素,例如,在I期临床试验中设置有效性或体内药效学观察指标,以收集有效性的初步证据。申请人有时会考虑将早期研究设计为I期和II期合并进行的I/II期试验,在剂量递增和推荐剂量明确后,进入扩展期,以推荐的剂量水平继续入组额外的患者,进一步观察免疫细胞治疗产品的疗效。如果采用该类设计,在试验方案中应明确从剂量递增阶段转到扩展阶段的原则和方法。
CAR-T不同于传统药物,本身具有分化活力,终产品异质性强,药效和药代由体内扩增细胞决定,与初始剂量无关。这些因素给CAR-T药学评价带来了很多挑战。1. Edward Z. Song and Michael C. Milone,Pharmacology of Chimeric Antigen Receptor–Modified T Cells,Annu. Rev. Pharmacol. Toxicol. 2021. 61:32.1–32.25
2. Golubovskaya V,Wu L. 2016. Different subsets of T cells, memory, effector functions, and CAR-T immunotherapy.Cancers 8:36
3. Fraietta JA, Lacey SF, Orlando EJ, Pruteanu-Malinici I, Gohil M, et al. 2018. Determinants of response and resistance to CD19 chimeric antigen receptor (CAR) T cell therapy of chronic lymphocytic leukemia. Nat. Med. 24:563–71
4. 免疫细胞治疗产品临床试验技术指导原则(征求意见稿)国家药品监督管理局药品审评中心生物制品临床部